tout d’abord, vous devez connaître le nombre d’électrons de valence. Vous pouvez le faire en (1) dessinant la configuration électronique par élément ou (2) en consultant votre tableau périodique.,
Si vous avez choisi de dessiner la configuration électronique par élément, vous aurez quelque chose comme ceci:
#N# (numéro atomique = 7) : #1s^2# #couleur (rouge) (2s^2)# #couleur (rouge) (2p^3)# (5 ultrapériphériques électrons)
#O# (numéro atomique = 8) : #1s^2# #couleur (rouge) (2s^2)# #couleur (rouge) (2p^4)# (6 ultrapériphériques électrons)
Si vous avez choisi de consulter votre tableau périodique, il suffit de remarquer que #N# appartiennent au Groupe 5A tandis que la #O# appartient au Groupe 6A. Le groupe nombre désigne le nombre de ultrapériphériques électrons.,
Maintenant que vous connaissez le nombre d’électrons de valence par élément, vous devez calculer le total d’électrons de valence pour le #NO_3^ »-1″# ion.
5 + (3 x 6) = 23 électrons
Mais comme la molécule entière a une charge -1, vous devez ajouter cela aussi. Le nombre total d’électrons de valence est donc de 24.
La prochaine chose à faire est de dessiner. Normalement, le premier élément de la formule chimique est l’atome central. Dans ce cas, l’atome #N #est entouré de trois atomes# O#.,
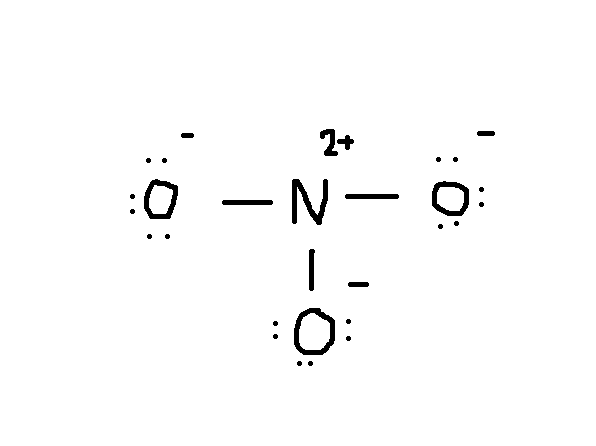
Notez que la seule paire d’électrons de #O# sont également inclus dans le diagramme. Si vous comptez le nombre total d’électrons sur le dessin ci-dessus, c’est déjà 24 électrons (une seule ligne compte comme 2 électrons). Mais ce dessin a violé la règle de l’octet puisque l’atome central n’a que 6 électrons au lieu du nombre correct 8. Alors, que faire?
Ajouter un autre lien, mais où?,
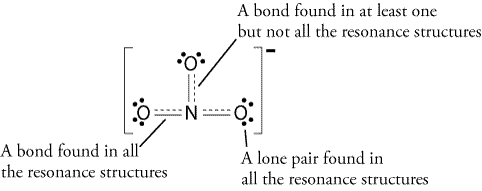
par conséquent, la structure de la résonance devrait ressembler à ceci: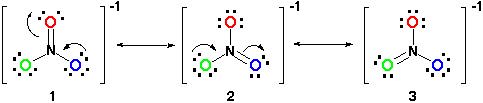
Toutes les structures de résonance sont corrects puisque tout suit la règle de l’octet et tous ont un nombre total de 24 électrons. Il suffit de prendre note que la seule liaison en mouvement est la liaison pi (#pi#) ou en termes simples, la double liaison et l’une des paires d’électrons de #O# atome.