cyclohexène propriétés chimiques,utilisations,Production
propriétés chimiques
le cyclohexène (C6H10, numéro de registre CAS 110-83-8) est également appelé tétrahydrobenzène, qui est un liquide inflammable incolore. Il est insoluble dans l’eau. L’Inhalation de concentrations élevées peut avoir un effet narcotique. Le cyclohexène est très inflammable, il doit donc rester à l’écart de la chaleur et des flammes nues. Il peut former des peroxydes en stockage, il doit donc être stocké en l’absence d’air. Il peut avoir des effets toxiques s’il est inhalé ou absorbé par la peau., L’Inhalation ou le contact avec du matériel Peut irriter ou brûler la peau et les yeux. D’incendie, le produit irritant, corrosif et/ou de gaz toxiques.
Cyclooléfine
le cyclohexène est une oléfine cyclique et est un liquide incolore et inflammable avec une odeur piquante spéciale à température ambiante. Placement à Long terme dans l’air il peut être oxydé en peroxyde par air. Naturellement présent dans le goudron de houille, soluble dans l’acétone, le tétrachlorure de carbone, le benzène, l’éther, l’hexane, l’éthanol et d’autres solvants organiques, peut former un azéotrope binaire avec des alcools inférieurs, de l’acide acétique, etc., Le cyclohexène a la nature générale de l’oléfine, se décompose rapidement en présence de sels d’uranium sous la lumière du soleil ou les rayons ultraviolets, est constant comme étant chauffé dans un tube scellé à 200 ℃ pendant une longue période, Forme du benzène et du naphtalène à 400~500 ℃.
Il est obtenu par déshydratation du cyclohexanol à haute température en présence d’un catalyseur acide industrielle. Il est obtenu par déshydratation sulfatée du cyclohexanol en laboratoire.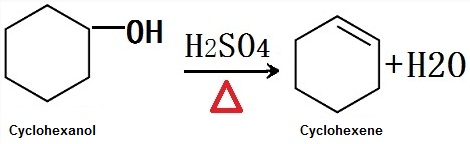
La Figure 1 est l’équation de réaction chimique de la déshydratation sulfatée du cyclohexanol pour obtenir le cyclohexène.,
le cyclohexène est une matière première chimique importante, utilisée pour la production d’acide adipique, d’aldéhyde adipique, d’acide maléique, d’acide Cyclohexane, d’aldéhyde cyclohexane, d’acide maléique, d’acide cyclohexyl carboxylique, de cyclohexanecarboaldéhyde dans l’industrie. Il est également utilisé comme agent d’extraction, le stabilisateur ayant une essence à indice d’octane élevé. L’Inhalation peut provoquer une intoxication légère.
voici quelques-uns de ces composés importants préparés par le cyclohexène, (1)le cyclohexane chloré est fabriqué, utile comme intermédiaires pharmaceutiques, un solvant et des additifs pour caoutchouc., (2) cyclohexanone est fabriqué à partir de cyclohexène, peut être utilisé comme matières premières intermédiaires de la médecine, des pesticides, des parfums et des colorants, comme modificateurs de polymère. (3) l’acétate de cyclohexyle est fabriqué, utilisé comme solvant plastique. (4) le phénol de cyclohexanone est fait, peut être employé comme médecine de matières premières et pesticides. (5) aminocyclohexanol est fait, peut être utilisé comme tensioactifs et émulsifiants. (6) le produit peut également être utilisé directement comme intermédiaires organiques, solvants et Additifs lors de la préparation d’épices. Il peut être utilisé dans la préparation du butadiène en laboratoire.,
les informations ci-dessus ont été éditées et rassemblées par Yan Yanyong de Chemicalbook.
préparation
le cyclohexène peut être synthétisé de plusieurs manières, telles que la déshydrogénation du cyclohexane, la déshydratation du cyclohexanol, la déshydrohalogénation du cyclohexane halogéné, la réduction du bouleau ou l’hydrogénation partielle du benzène. Comparé à d’autres méthodes, la technologie de l’hydrogénation partielle du benzène au cyclohexène est de l’avantage de la sécurité, de la haute atome-économie, favorable à l’environnement. L’hydrogénation partielle du benzène en cyclohexène est connue depuis plus de 100 ans.,
propriétés chimiques
liquide inflammable incolore. Insoluble dans l’eau, soluble dans l’éther.
oxydation sélective
le cyclohexène peut réagir vigoureusement avec des agents oxydants puissants., Bien que simple dans sa structure chimique, il existe deux sites d’oxydation potentiels dans le cyclohexène, et les réactions d’oxydation habituelles conduisent généralement à un mélange de produits avec différents états d’oxydation et groupes fonctionnels: l’oxydation de la liaison C=C (site a) peut conduire à 7-oxabicycloheptane, trans/cis-cyclohexane-1,2-diol ou acide adipique; l’oxydation en position allylique C-H (site b) peut 1-un., Ces produits sont des intermédiaires industriels utiles qui ont été largement utilisés dans la synthèse organique, la chimie médicinale, la chimie des pesticides, la science des matériaux, etc. Par conséquent, les réactions d’oxydation contrôlables pour le cyclohexène qui peuvent permettre sélectivement les produits ciblés sont synthétiquement précieuses pour les applications à la fois dans l’Académie et l’industrie, devenant ainsi l’objectif des chimistes synthétiques et catalytiques dans le domaine.
Utilise
- Utilisé en synthèse organique, il est également utilisé comme solvant.,
- le cyclohexène est utilisé comme matières premières synthétiques organiques, telles que les matières premières synthétiques pour la lysine, la cyclohexanone, le phénol, la résine de polycyclooléfine, le cyclohexane chloré, les additifs pour caoutchouc, le cyclohexanol, etc. Il est également utilisé comme solvant de catalyseur et agent d’extraction de pétrole, stabilisateur d’essence à indice d’octane élevé.
- le cyclohexène est utilisé pour la préparation de l’acide adipique, de l’acide maléique, de l’acide hexahydro-benzoïque et de l’acétaldéhyde, la préparation du butadiène en laboratoire. Il est utilisé comme stabilisateur d’essence à indice d’octane élevé.,
procédé de Production
le Cyclohexanol est chauffé pour générer du cyclohexène en présence d’un catalyseur à l’acide sulfurique, distillé pour obtenir des produits bruts. Lavé avec une fine solution de sel saturé, puis une solution de sulfate de sodium est utilisé pour neutraliser les traces d’acide, puis lavé avec de l’eau, en couches, séché, filtration, distillation, collecte 82-85 ℃ distillat produits pour obtenir cyclohexène.
caractéristiques de danger D’Inflammabilité
en cas d’incendie, haute température, oxydant, il est inflammable, la combustion produit une fumée irritante.,
caractéristiques de stockage
ventilation du Trésor séchage à basse température, stocké séparément des oxydants et des acides. Stockage pas long pour empêcher la polymérisation.
propriétés chimiques
le cyclohexène est un liquide incolore (cyclicalkène) avec une odeur sucrée.
Propriétés physiques
liquide clair et incolore avec une odeur douce. La concentration seuil d’odeur est de 0,18 ppm (Cité, Amoore et Hautala, 1983).
utilisations
il se produit dans le goudron de houille et est obtenu par catalyticdéhydratation du cyclohexanol et déshydrogénation du cyclohexane., Cyclohexene isused en faisant l’acide adipique,l’acide maléique, et le butadiène; dans l’extraction d’huile; comme essence de haut-octane de stabilizerfor; et dans organicsynthesis.
utilise un composant D’Alkylation
. Dans la fabrication de l’acide adipique, l’acide maléique, hexahydrobenzoic de l’acide et de l’aldéhyde. Pour préparer le butadiène en laboratoire. A été suggéré pour la synthèse de l’acide maléique et comme stabilisateur pour l’essence à indice d’octane élevé.,
utilisations
fabrication d’acide adipique, d’acide maléique, d’acide hexahydrobenzoïque et d’aldéhyde; stabilisant pour l’essence à indice d’octane élevé
méthodes de Production
le cyclohexène est préparé par déshydratation du cyclohexanol par réaction thermique d’un mélange éthylène-propylène–butadiène(1).
définition
ChEBI: un cycloalcène qui est cylohexane avec une double liaison simple.
Description générale
un liquide incolore. Insoluble dans l’eau et moins dense que l’eau. Point d’éclair 20 ° F. vapeurs plus lourdes que l’air. L’Inhalation de concentrations élevées peut avoir un effet narcotique. Utilisé pour fabriquer d’autres produits chimiques.,
Air & réactions de L’eau
hautement inflammable. Insoluble dans l’eau.
profil de réactivité
le cyclohexène peut réagir vigoureusement avec des agents oxydants puissants. Peut réagir exothermiquement avec des agents réducteurs pour libérer de l’hydrogène gazeux. En présence de divers catalyseurs (tels que des acides) ou des initiateurs, peuvent subir des réactions de polymérisation par addition exothermique. S’oxyde facilement dans l’air pour former des peroxydes instables qui peuvent exploser spontanément .
danger pour la santé
il existe très peu de données toxicologiques disponibles sur le cyclohexène., L’Inhalation produitirritation des yeux et des voies respiratoires. Il reste aussi un irritant pour la peau. Sa toxicité aiguë est faible; les effets toxiques sont similaires à ceux du cyclohexane. Exposition à des concentrations élevéesou l’ingestion peut causer de la somnolence.Une exposition unique à 15 000 ppm de cyclohexène pourrait être mortelle pour les rats.
risque D’incendie
très inflammable: sera facilement enflammé par la chaleur, des étincelles ou des flammes. Les vapeurs peuvent former des mélanges explosifs avec l’air. Les vapeurs peuvent se déplacer vers la source d’inflammation et revenir en arrière. La plupart des vapeurs sont plus lourdes que l’air., Ils se répandront le long du sol et s’accumuleront dans des zones basses ou confinées (égouts, sous-sols, réservoirs). Risque d’explosion de vapeur à l’intérieur, à l’extérieur ou dans les égouts. Le ruissellement vers les égouts peut créer un risque d’incendie ou d’explosion. Les conteneurs peuvent exploser lorsqu’ils sont chauffés. De nombreux liquides sont plus légers que l’eau.
profil de sécurité
modérément toxique par inhalation et ingestion. Un risque d’incendie très dangereux lorsqu’il est exposé à la flamme; peut réagir avec les oxydants. Dangereux; tenir à l’écart dela chaleur et la flamme nue. Pour lutter contre le feu, utilisez de la mousse, du CO2, des produits chimiques secs.,
Exposition Potentielle
peut être utilisé comme intermédiaire dans la fabrication d’autres produits chimiques (par exemple, l’acide adipique, l’acide maléique, l’acide hex-ahydro-benzoïque), l’extraction d’huile et comme catalyseur.
Cancérogénicité
le cyclohexène n’a pas été mutagène chez Salmonellatyphimurium avec ou sans activation métabolique.
devenir Environnemental
biologique. Le cyclohexène se biodégrade en cyclohexanone (Dugan, 1972; Verschueren, 1983).
Photolytique. Les constantes de vitesse suivantes ont été rapportées pour la réaction du cyclohexène avec les Ohradicaux dans l’atmosphère: 6,80 x 10-11 cm3/molécule?sec (Atkinson et coll., 1979), 6.,75 x 10-11cm3 / molécule?sec à 298 K (Sablji? et Güsten, 1990), 5,40 x 10-11 cm3/molécule?sec à 298 K (Rogers, 1989), 1,0 x 10-10 cm3/molécule?sec à 298 K (Atkinson, 1990); avec de l’ozone en phase gazeuse:1,69 x 10-16 cm3/molécule?sec à 298 K (Japar et coll., 1974), 2,0 x 10-16 à 294 K (Adeniji etal., 1981), de 1,04 x 10-16 cm3/molécules?sec (Atkinson et coll., 1983), 1,04 x 10-16 à 298 K (Atkinsonand Carter, 1984); avec NO3 dans l’atmosphère: 5,26 x 10-13 cm3/molécule?sec (Sablji? et Güsten, 1990); 5,3 x 10-13 cm3/molécule?sec à 298 K (Atkinson, 1990), et 5,28 x 10-13 cm3/molécule?,secat 295 K (Atkinson, 1991). Cox et coll. (1980) ont rapporté une constante de vitesse de 6,2 x 10-11cm3/molécule?sec pour la réaction du cyclohexène gazeux avec les radicaux OH sur la base d’une valeur de 8x 10-12 cm3/molécule?sec pour la réaction de l’éthylène avec les radicaux OH.
Chimique/Physique. Les produits gazeux formés par la réaction du cyclohexène avec l’ozone étaient (%de rendement): acide formique , monoxyde de carbone , dioxyde de carbone, éthylène etvaléraldéhyde (Hatakeyama et al., 1987). Dans une expérience de chambre de smog menée dans ledark à 25 °C, le cyclohexane a réagi avec l’ozone., The following products and their respective molaryields were: oxalic acid (6.16%), malonic acid (6.88%), succinic acid (0.63%), glutaric acid(5.89%), adipic acid (2.20%), 4-hydroxybutanal (2.60%), hydroxypentanoic acid (1.02%),hydroxyglutaric acid (2.33%), hydroxyadipic acid (1.19%), 4-oxobutanoic acid (6.90%), 4-oxopentanoic acid (4.52%), 6-oxohexanoic acid (4.16%), 1,4-butandial (0.53%), 1,5-pentanedial(0.44%), 1,6-hexanedial (1.64%), and pentanal (17.05%).
Grosjean et al., (1996) investigated the atmospheric chemistry of cyclohexene with ozone and anozone-nitrogen oxide mixture under ambient conditions. The reaction of cyclohexene and ozone inthe dark yielded pentanal and cyclohexanone. The sunlight irradiation of cyclohexene with ozonenitrogenoxide yielded the following carbonyls: formaldehyde, acetaldehyde, acetone, propanal,butanal, pentanal, and a C4 carbonyl.
Cyclohexene reacts with chlorine dioxide in water forming 2-cyclohexen-1-one (Rav-Acha etal., 1987).
Shipping
UN2256 Cyclohexene, Hazard Class: 3; Labels:3-Flammable liquid.,
méthodes de Purification
libérer le cyclohexène des peroxydes par lavage avec des portions successives de sulfate ferreux acidifié dilué, ou avec une solution de NaHSO3, puis avec de l’eau distillée, séchage avec CaCl2 ou CaSO4, et distillation sous N2. Des méthodes alternatives pour éliminer les peroxydes comprennent le passage à travers une colonne d’alumine, le reflux avec du fil de sodium ou du stéarate cuprique (puis la distillation à partir de sodium). Le diène est éliminé par reflux avec de l’anhydride maléique avant distillation sous vide. Le traitement avec 0,1 moles de MeMgI dans 40 ml d’éther diéthylique élimine les traces d’impuretés oxygénées., D’autres procédures de purification comprennent le lavage avec du NaOH aqueux, le séchage et la distillation sous N2 à travers une colonne de bande de filage, le redistillage à partir de CaH2, le stockage sous fil de sodium et le passage à travers une colonne d’alumine, sous N2, immédiatement avant utilisation. Stocker à
incompatibilités
vapeur peut former un mélange explosif withair. La substance peut former des peroxydes explosifs. La sous-position peut polymériser dans certaines conditions.Incompatible avec les oxydants (chlorates, nitrates,peroxydes, permanganates, perchlorates, chlore, brome,fluor, etc.); contact peut provoquer des incendies ou des explosions., Gardez à l’écart des matériaux alcalins, des bases fortes, des acides forts, des oxoa-cids, des époxydes.
élimination des déchets
dissoudre ou mélanger le matériau avec un solvant combustible et brûler dans un incinérateur chimique équipé d’une postcombustion et d’un épurateur. Toutes les réglementations environnementales fédérales,étatiques et locales doivent êtreobservées.