objectifs D’apprentissage
- comparer les mutations ponctuelles et les mutations frameshift
- décrire les différences entre les mutations missense, non-sens et silencieuses
- décrire les différences entre la réparation claire et la réparation sombre
- expliquer comment différents mutagènes agissent
- expliquer pourquoi le test D’Ames peut être utilisé pour détecter des carcinogènes
- analyser des séquences des types de mutations
une mutation est un changement héréditaire dans la séquence d’ADN d’un organisme., L’organisme résultant, appelé mutant, peut présenter un changement de phénotype reconnaissable par rapport au type sauvage, qui est le phénotype le plus couramment observé dans la nature. Une modification de la séquence D’ADN est conférée à l’ARNm par transcription, et peut conduire à une séquence d’acides aminés altérée dans une protéine lors de la traduction. Étant donné que les protéines remplissent la grande majorité des fonctions cellulaires, une modification de la séquence des acides aminés dans une protéine peut entraîner une modification du phénotype de la cellule et de l’organisme.,
effets des Mutations sur la séquence D’ADN
Il existe plusieurs types de mutations qui sont classées en fonction de la façon dont la molécule d’ADN est modifiée. Un type, appelé mutation ponctuelle, affecte une seule base et se produit le plus souvent lorsqu’une base est substituée ou remplacée par une autre. Des Mutations aussi résulter de l’addition d’un ou de plusieurs bases, connu comme l’insertion ou la suppression d’une ou plusieurs bases, connu comme une suppression.
Penser
- Quel type de mutation se produit lorsqu’un gène a deux de moins de nucléotides dans la séquence?,
effets des Mutations sur la Structure et la fonction des protéines
Les mutations ponctuelles peuvent avoir un large éventail d’effets sur la fonction des protéines (Figure 1). En conséquence de la dégénérescence du code génétique, une mutation ponctuelle entraînera généralement l’incorporation du même acide aminé dans le polypeptide résultant malgré le changement de séquence. Ce changement n’aurait aucun effet sur la structure de la protéine, et est donc appelé une mutation silencieuse. Une mutation missense entraîne l’incorporation d’un acide aminé différent dans le polypeptide résultant., L’effet d’une mutation missense dépend de la différence chimique entre le nouvel acide aminé et l’acide aminé de type sauvage. L’emplacement de l’acide aminé modifié dans la protéine est également important. Par exemple, si l’acide aminé modifié fait partie du site actif de l’enzyme, l’effet de la mutation missense peut être significatif. De nombreuses mutations missense entraînent des protéines qui sont encore fonctionnelles, au moins dans une certaine mesure. Parfois, les effets des mutations missense ne peuvent être apparents que dans certaines conditions environnementales; de telles mutations missense sont appelées mutations conditionnelles., Rarement, une mutation missense peut être bénéfique. Dans les bonnes conditions environnementales, ce type de mutation peut donner à l’organisme qui l’héberge un avantage sélectif. Encore un autre type de mutation ponctuelle, appelée mutation non-sens, convertit un codon codant un acide aminé (un codon sens) en un codon stop (un codon non-sens). Les mutations non-sens entraînent la synthèse de protéines plus courtes que le type sauvage et généralement non fonctionnelles.
les suppressions et les insertions provoquent également divers effets., Étant donné que les codons sont des triplets de nucléotides, les insertions ou les délétions en groupes de trois nucléotides peuvent conduire à l’insertion ou à la délétion d’un ou plusieurs acides aminés et ne peuvent pas avoir d’effets significatifs sur la fonctionnalité de la protéine résultante. Cependant, les mutations frameshift, causées par des insertions ou des suppressions d’un certain nombre de nucléotides qui ne sont pas un multiple de trois, sont extrêmement problématiques car un décalage dans le cadre de lecture résulte (Figure 1). Parce que les ribosomes lisent l’ARNm dans les codons triplets, les mutations frameshift peuvent changer chaque acide aminé après le point de la mutation., Le nouveau cadre de lecture peut également comprendre un codon d’arrêt avant la fin de la séquence de codage. Par conséquent, les protéines fabriquées à partir de gènes contenant des mutations frameshift sont presque toujours non fonctionnelles.
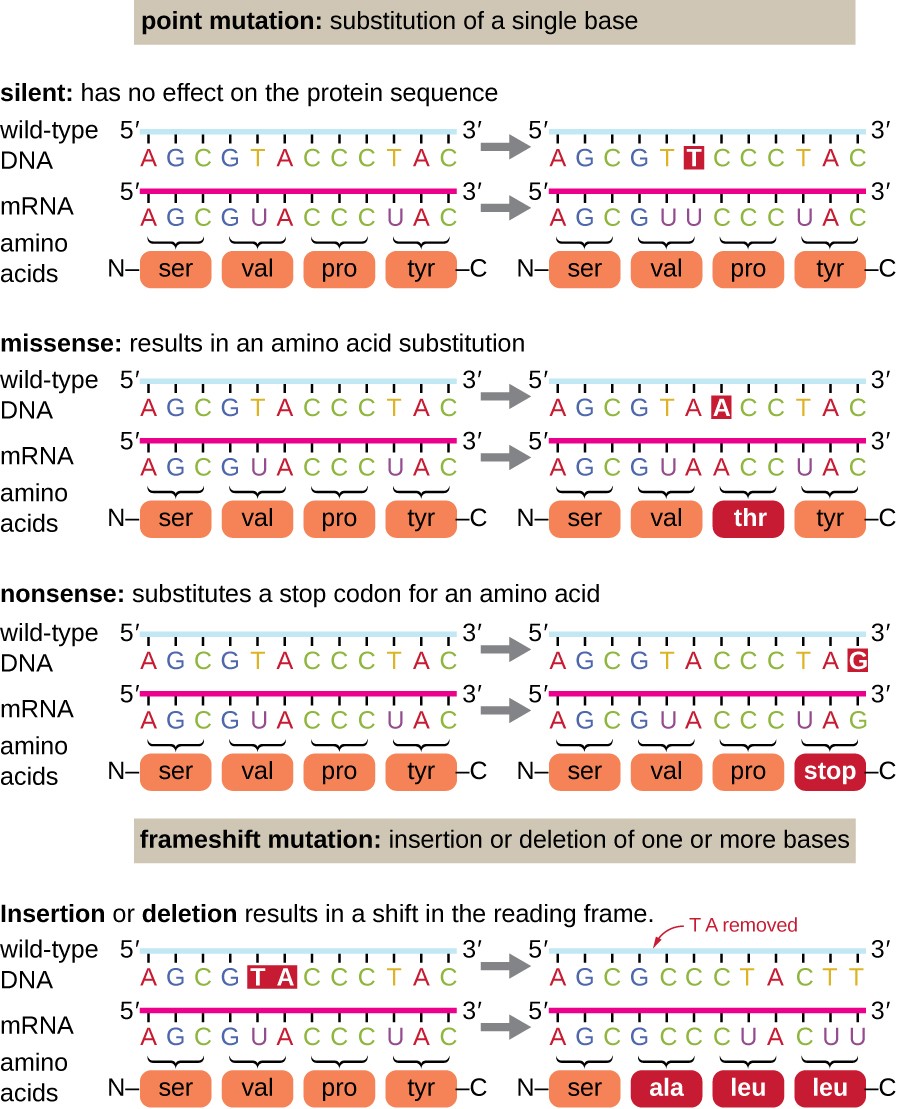
la Figure 1. Cliquez pour voir une image plus grande. Les Mutations peuvent entraîner des modifications de la séquence protéique codée par l’ADN.
Penser
- Quelles sont les raisons d’un changement de nucléotides d’un gène pour une protéine pourrait ne pas avoir d’effet sur le phénotype de ce gène?,
- est-il possible qu’une insertion de trois nucléotides ensemble après le cinquième nucléotide dans un gène codant une protéine produise une protéine plus courte que la normale? Comment ou comment pas?
une Mutation bénéfique
Depuis que le premier cas d’infection par le virus de l’immunodéficience humaine (VIH) a été signalé en 1981, près de 40 millions de personnes sont mortes de l’infection par le VIH, Le virus responsable du syndrome d’immunodéficience acquise (SIDA)., Le virus cible les lymphocytes T auxiliaires qui jouent un rôle clé dans le pontage de la réponse immunitaire innée et adaptative, infectant et tuant les cellules normalement impliquées dans la réponse de l’organisme à l’infection. Il n’y a pas de remède contre l’infection par le VIH, mais de nombreux médicaments ont été développés pour ralentir ou bloquer la progression du virus. Bien que des personnes dans le monde entier puissent être infectées, la prévalence la plus élevée parmi les personnes âgées de 15 à 49 ans est en Afrique subsaharienne, où près d’une personne sur 20 est infectée, représentant plus de 70% des infections dans le monde (Figure 2)., Malheureusement, c’est aussi une partie du monde où les stratégies de prévention et les médicaments pour traiter l’infection font le plus défaut.

la Figure 2. Le VIH est très répandu en Afrique subsaharienne, mais sa prévalence est assez faible dans d’autres régions du monde.
ces dernières années, l’intérêt scientifique a été suscité par la découverte de quelques individus d’Europe du Nord résistants à L’infection par le VIH. En 1998, le généticien américain Stephen J., O’Brien aux National Institutes of Health (NIH) et ses collègues ont publié les résultats de leur analyse génétique de plus de 4 000 individus. Ceux-ci ont indiqué que de nombreux individus D’ascendance eurasienne (jusqu’à 14% dans certains groupes ethniques) ont une mutation de délétion, appelée CCR5-delta 32, dans le gène codant CCR5. CCR5 est un corécepteur trouvé à la surface des lymphocytes T qui est nécessaire pour que de nombreuses souches du virus pénètrent dans la cellule hôte. La mutation conduit à la production d’un récepteur auquel le VIH ne peut pas se lier efficacement et bloque ainsi l’entrée virale., Les personnes homozygotes pour cette mutation ont considérablement réduit la susceptibilité à L’infection par le VIH, et celles qui sont hétérozygotes ont également une certaine protection contre l’infection.
Il n’est pas clair pourquoi les personnes d’origine nord-européenne, en particulier, portent cette mutation, mais sa prévalence semble être la plus élevée en Europe du Nord et diminue régulièrement au fur et à mesure que l’on se déplace vers le sud. La recherche indique que la mutation est présente depuis avant L’apparition du VIH et peut avoir été sélectionnée dans les populations européennes à la suite d’une exposition à la peste ou à la variole., Cette mutation peut protéger les individus contre la peste (causée par la bactérie Yersinia pestis) et la variole (causée par le virus de la variole) car ce récepteur peut également être impliqué dans ces maladies. L’âge de cette mutation est un sujet de débat, mais les estimations suggèrent qu’elle est apparue entre 1875 ans à 225 ans, et pourrait avoir été propagée du Nord de l’Europe par les invasions vikings.
Cette découverte passionnante a ouvert de nouvelles voies dans la recherche sur le VIH, y compris la recherche de médicaments pour bloquer la liaison du CCR5 au VIH chez les personnes dépourvues de la mutation., Bien qu’il soit possible d’effectuer des tests ADN pour déterminer quels individus sont porteurs de la mutation CCR5-delta 32, Il existe des cas documentés d’individus homozygotes pour la mutation contractant le VIH. Pour cette raison, les tests ADN pour la mutation ne sont pas largement recommandés par les responsables de la santé publique afin de ne pas encourager les comportements à risque chez ceux qui portent la mutation. Néanmoins, l’inhibition de la liaison du VIH au CCR5 reste une stratégie valable pour le développement de thérapies médicamenteuses pour les personnes infectées par le VIH.,
Causes des Mutations
des erreurs dans le processus de réplication de l’ADN peuvent provoquer des mutations spontanées. Le taux d’erreur de L’ADN polymérase est d’une base incorrecte par milliard de paires de bases répliquées. L’exposition aux mutagènes peut provoquer des mutations induites, qui sont divers types d’agents chimiques ou de radiations (Tableau 1). L’exposition à un mutagène peut augmenter le taux de mutation de plus de 1000 fois. Les mutagènes sont souvent aussi des cancérigènes, des agents qui causent le cancer. Cependant, alors que presque tous les agents cancérigènes sont mutagènes, tous les mutagènes ne sont pas nécessairement cancérigènes.,
| le Tableau 1., to AT base pair | Point | |||
|---|---|---|---|---|
| Intercalating agents | ||||
| Acridine orange, ethidium bromide, polycyclic aromatic hydrocarbons | Distorts double helix, creates unusual spacing between nucleotides | Introduces small deletions and insertions | Frameshift | |
| Ionizing radiation | ||||
| X-rays, γ-rays | Forms hydroxyl radicals | Causes single- and double-strand DNA breaks | Repair mechanisms may introduce mutations | |
| X-rays, γ-rays | Modifies bases (e., | convertit le GC en une paire de base | Point | |
| rayonnement non ionisant | ||||
| Ultraviolet | forme des dimères de pyrimidine (généralement de la thymine) | provoque des erreurs de réplication de L’ADN | Frameshift ou point | |
mutagènes chimiques
différents types de mutagènes chimiques interagissent directement avec l’ADN, soit en agissant comme analogues nucléosidiques, soit en modifiant les bases nucléotidiques., Les produits chimiques appelés analogues nucléosidiques sont structurellement similaires aux bases nucléotidiques normales et peuvent être incorporés dans l’ADN pendant la réplication (Figure 3). Ces analogues de base induisent des mutations parce qu’ils ont souvent des règles d’appariement de base différentes de celles des bases qu’ils remplacent. D’autres mutagènes chimiques peuvent modifier les bases D’ADN normales, ce qui entraîne différentes règles d’appariement des bases. Par exemple, l’acide nitreux désamine la cytosine, la convertissant en uracile. L’uracile s’associe ensuite à l’adénine dans un cycle de réplication ultérieur, ce qui entraîne la conversion d’une paire de bases GC en une paire de bases AT., L’acide nitreux désamine également l’adénine en hypoxanthine, qui s’associe à la cytosine au lieu de la thymine, ce qui entraîne la conversion d’une paire de bases TA en une paire de bases CG.

la Figure 3. Cliquez pour voir une image plus grande. (a) le nucléoside 2-aminopurine (2AP) est structurellement un analogue nucléosidique du nucléoside adénine, tandis que le 5-bromouracile (5BU) est un analogue nucléosidique du nucléoside thymine. Paires de base 2AP avec C, convertissant une paire de base AT en une paire de base GC après plusieurs cycles de réplication., 5BU s’apparie avec G, convertissant une paire de base AT en une paire de base GC après plusieurs cycles de réplication. (B) l’acide nitreux est un autre type de mutagène chimique qui modifie les bases nucléosidiques déjà existantes comme C pour produire U, qui paires de bases avec A. Cette modification chimique, comme illustré ici, entraîne la conversion d’une paire de bases CG en une paire de bases TA.
les mutagènes chimiques appelés agents intercalants fonctionnent différemment., Ces molécules glissent entre les bases azotées empilées de la double hélice D’ADN, déformant la molécule et créant un espacement atypique entre les paires de bases nucléotidiques (Figure 4). En conséquence, pendant la réplication de L’ADN, L’ADN polymérase peut soit sauter la réplication de plusieurs nucléotides (créant une délétion) ou insérer des nucléotides supplémentaires (créant une insertion). L’un ou l’autre résultat peut conduire à une mutation frameshift. Les produits de Combustion comme les hydrocarbures aromatiques polycycliques sont des agents intercalants particulièrement dangereux qui peuvent entraîner des cancers causés par des mutations., Les agents intercalants bromure d’éthidium et orange d’acridine sont couramment utilisés en laboratoire pour colorer L’ADN pour la visualisation et sont des mutagènes potentiels.

la Figure 4. Les agents intercalants, tels que l’acridine, introduisent un espacement atypique entre les paires de bases, ce qui entraîne L’introduction d’une délétion ou d’une insertion de L’ADN polymérase, conduisant à une mutation frameshift potentielle.
rayonnement
L’exposition à des rayonnements ionisants ou non ionisants peut induire des mutations dans L’ADN, bien que par des mécanismes différents., Les rayonnements ionisants forts tels que les rayons X et les rayons gamma peuvent provoquer des ruptures à simple et double brin dans l’épine dorsale de l’ADN par la formation de radicaux hydroxyles lors de l’exposition aux rayonnements (Figure 5). Les rayonnements ionisants peuvent également modifier les bases; par exemple, la désamination de la cytosine en uracile, analogue à l’action de l’acide nitreux. L’exposition aux rayonnements ionisants est utilisée pour tuer les microbes afin de stériliser les dispositifs médicaux et les aliments, en raison de son effet non spécifique spectaculaire qui endommage L’ADN, les protéines et d’autres composants cellulaires (voir utilisation de méthodes physiques pour contrôler les micro-organismes).,
Les rayonnements non ionisants, comme la lumière ultraviolette, ne sont pas assez énergétiques pour initier ces types de changements chimiques. Cependant, les rayonnements non ionisants peuvent induire la formation de dimères entre deux bases pyrimidines adjacentes, généralement deux thymines, dans un brin nucléotidique. Au cours de la formation de dimères de thymine, les deux thymines adjacentes deviennent liées de manière covalente et, si elles ne sont pas réparées, la réplication et la transcription de l’ADN sont bloquées à ce stade. L’ADN polymérase peut procéder et répliquer le dimère de manière incorrecte, entraînant potentiellement des mutations de frameshift ou de point.,

la Figure 5. (a) les rayonnements ionisants peuvent entraîner la formation de ruptures monocaténaire et bicaténaire dans l’épine dorsale sucre-phosphate de L’ADN, ainsi que la modification des bases (non représenté). b) les rayonnements non ionisants tels que les rayons ultraviolets peuvent entraîner la formation de dimères de thymine, qui peuvent bloquer la réplication et la transcription et introduire des mutations à décalage de trame ou ponctuelles.
Penser
- Comment fonctionne une base analogique introduire une mutation?,
- Comment un agent intercalant introduire une mutation?
- quel type de mutagène provoque les dimères de thymine?
réparation de L’ADN
le processus de réplication de l’ADN est très précis, mais des erreurs peuvent survenir spontanément ou être induites par des mutagènes. Des erreurs non corrigées peuvent entraîner de graves conséquences pour le phénotype. Les cellules ont développé plusieurs mécanismes de réparation pour minimiser le nombre de mutations qui persistent.,
relecture
la plupart des erreurs introduites lors de la réplication de l’ADN sont rapidement corrigées par la plupart des ADN polymérases grâce à une fonction appelée relecture. Lors de la relecture, L’ADN polymérase lit La base nouvellement ajoutée, s’assurant qu’elle est complémentaire de la base correspondante dans le brin de gabarit avant d’ajouter la suivante. Si une base incorrecte a été ajoutée, l’enzyme fait une coupe pour libérer le mauvais nucléotide et une nouvelle base est ajoutée.,
réparation des incompatibilités
certaines erreurs introduites lors de la réplication sont corrigées peu de temps après le déplacement de la machine de réplication. Ce mécanisme est appelé réparation de non-concordance. Les enzymes impliquées dans ce mécanisme reconnaissent le nucléotide incorrectement ajouté, l’excisent et le remplacent par la base correcte. Un exemple est la réparation de l’inadéquation dirigée par le méthyle chez E. coli. L’ADN est hemimethylated. Cela signifie que le brin parental est méthylé alors que le brin fille nouvellement synthétisé ne l’est pas. Il faut plusieurs minutes avant que le nouveau brin soit méthylé., Les protéines MutS, MutL et MutH se lient au site hémiméthylé où le nucléotide incorrect est trouvé. MutH coupe le brin non méthylé (le nouveau brin). Une exonucléase enlève une partie du brin (y compris le nucléotide incorrect). L’espace formé est ensuite comblé par L’ADN pol III et la ligase.
réparation des dimères de Thymine
comme la production de dimères de thymine est courante (de nombreux organismes ne peuvent éviter la lumière ultraviolette), des mécanismes ont évolué pour réparer ces lésions., Dans la réparation par excision de nucléotides (également appelée réparation sombre), les enzymes éliminent le dimère de pyrimidine et le remplacent par les nucléotides corrects (Figure 6). Chez E. coli, l’ADN est scanné par un complexe enzymatique. Si l’on constate une distorsion dans la double hélice qui a été introduite par le dimère de pyrimidine, le complexe enzymatique coupe le squelette sucre-phosphate de plusieurs bases en amont et en aval du dimère, et le segment D’ADN entre ces deux Coupes est alors éliminé enzymatiquement. L’ADN pol I remplace les nucléotides manquants par les nucléotides corrects et L’ADN ligase scelle l’espace dans l’épine dorsale sucre-phosphate.,
la réparation directe (également appelée réparation de la lumière) des dimères de thymine se produit par le processus de photoréactivation en présence de lumière visible. Une enzyme appelée photolyase reconnaît la distorsion dans l’hélice d’ADN causée par le dimère de thymine et se lie au dimère. Ensuite, en présence de lumière visible, l’enzyme photolyase change de conformation et sépare le dimère de thymine, permettant aux thymines de s’apparier à nouveau correctement avec les adénines sur le brin complémentaire., La photoréactivation semble être présente dans tous les organismes, à l’exception des mammifères placentaires, y compris les humains. La photoréactivation est particulièrement importante pour les organismes chroniquement exposés au rayonnement ultraviolet, comme les plantes, les bactéries photosynthétiques, les algues et les coraux, afin de prévenir l’accumulation de mutations causées par la formation de dimères de thymine.

la Figure 6. Cliquez pour voir une image plus grande. Les bactéries ont deux mécanismes pour réparer les dimères de thymine., (a) dans la réparation d’excision de nucléotides, un complexe enzymatique reconnaît la distorsion dans le complexe D’ADN autour du dimère de thymine et coupe et enlève le brin d’ADN endommagé. Les nucléotides corrects sont remplacés par L’ADN pol I et le brin nucléotidique est scellé par L’ADN ligase. (b) lors de la photoréactivation, l’enzyme photolyase se lie au dimère de thymine et, en présence de lumière visible, brise le dimère, rétablissant l’appariement de base des thymines avec des adénines complémentaires sur le brin D’ADN opposé.,
pensez-y
- lors de la réparation de la discordance, comment l’enzyme reconnaît-elle Quel est le nouveau et quel est l’ancien brin?
- Comment un agent intercalant introduire une mutation?
- quel type de mutation la photolyase répare-t-elle?
identification des Mutants bactériens
Une technique courante utilisée pour identifier les mutants bactériens est appelée Replica plating., Cette technique est utilisée pour détecter les mutants nutritionnels, appelés auxotrophes, qui ont une mutation dans un gène codant pour une enzyme dans la voie de biosynthèse d’un nutriment spécifique, tel qu’un acide aminé. En conséquence, alors que les cellules de type sauvage conservent la capacité de se développer normalement sur un milieu dépourvu du nutriment spécifique, les auxotrophes sont incapables de se développer sur un tel milieu. Au cours du repiquage (Figure 7), une population de cellules bactériennes est mutagénisée puis plaquée en tant que cellules individuelles sur une plaque complexe nutritionnellement complète et laissée se développer en colonies., Les cellules de ces colonies sont retirées de cette plaque maîtresse, souvent à l’aide de velours stérile. Ce velours, contenant des cellules, est ensuite pressé dans la même orientation sur des plaques de divers supports. Au moins une plaque doit également être nutritionnellement complète pour s’assurer que les cellules sont correctement transférées entre les plaques. Les autres plaques manquent de nutriments spécifiques, ce qui permet au chercheur de découvrir divers mutants auxotrophes incapables de produire des nutriments spécifiques. Les cellules de la colonie correspondante sur la plaque nutritionnellement complète peuvent être utilisées pour récupérer le mutant pour une étude plus approfondie.,

la Figure 7. L’Identification des mutants auxotrophes, comme les auxotrophes de l’histidine, se fait à l’aide d’un placage de réplique. Après mutagenèse, les colonies qui poussent sur un milieu nutritionnellement complet mais pas sur un milieu dépourvu d’histidine sont identifiées comme des auxotrophes d’histidine.
pensez-y
- pourquoi les cellules sont-elles plaquées sur une plaque nutritionnellement complète en plus des plaques déficientes en nutriments lors de la recherche d’un mutant?,
le Test D’Ames
le test d’ames, développé par Bruce Ames (1928–) dans les années 1970, est une méthode qui utilise des bactéries pour un dépistage rapide et peu coûteux du potentiel cancérigène de nouveaux composés chimiques. Le test mesure le taux de mutation associé à l’exposition au composé, ce qui, s’il est élevé, peut indiquer que l’exposition à ce composé est associée à un risque de cancer plus élevé., Le test d’Ames utilise comme organisme de test une souche de Salmonella typhimurium qui est une histidine auxotrophe, incapable de synthétiser sa propre histidine en raison d’une mutation dans un gène essentiel nécessaire à sa synthèse. Après exposition à un mutagène potentiel, ces bactéries sont plaquées sur un milieu dépourvu d’histidine, et le nombre de mutants retrouvant la capacité de synthétiser l’histidine est enregistré et comparé au nombre de tels mutants qui apparaissent en l’absence du mutagène potentiel (Figure 8)., Les produits chimiques qui sont plus mutagènes provoqueront plus de mutants avec la synthèse restaurée de l’histidine dans le test D’Ames. Parce que de nombreux produits chimiques ne sont pas directement mutagènes mais sont métabolisés en formes mutagènes par des enzymes hépatiques, l’extrait de foie de rat est généralement inclus au début de cette expérience pour imiter le métabolisme du foie. Après le test D’Ames, les composés identifiés comme mutagènes sont testés pour leurs propriétés cancérigènes potentielles en utilisant d’autres modèles, y compris des modèles animaux comme les souris et les rats.
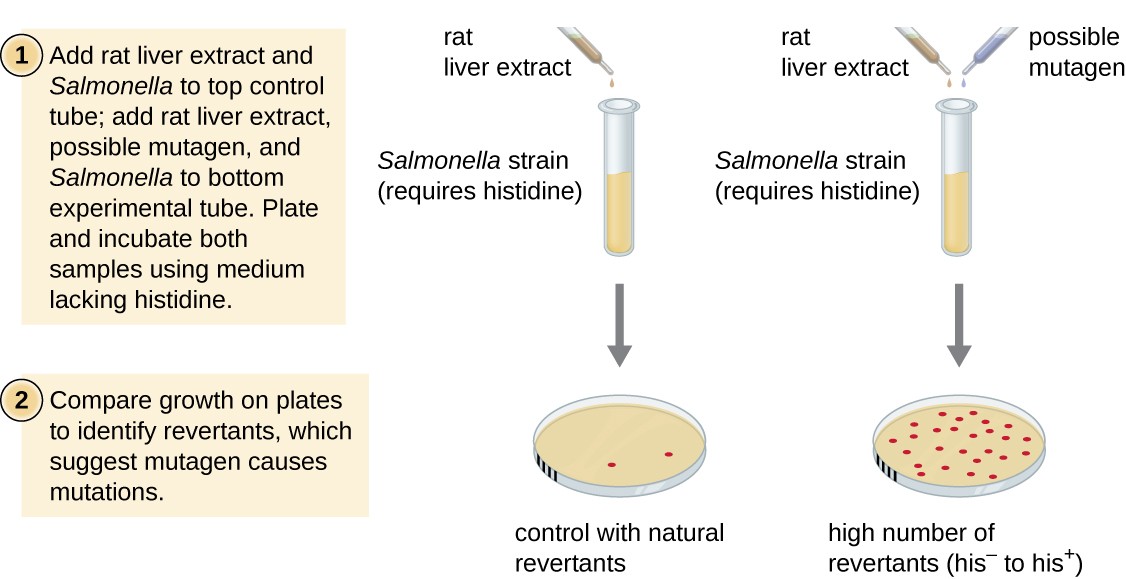
la Figure 8., Le test D’Ames est utilisé pour identifier les produits chimiques mutagènes, potentiellement cancérigènes. Une Salmonella histidine auxotrophe est utilisée comme souche d’essai, exposée à un mutagène/cancérigène potentiel. Le nombre de mutants de réversion capables de croître en l’absence d’histidine fournie est compté et comparé au nombre de mutants de réversion naturels qui apparaissent en l’absence du mutagène potentiel.
Penser
- Quelle mutation est utilisé comme un indicateur du taux de mutation dans le test d’Ames?
- pourquoi le test Ames peut-il fonctionner comme un test de cancérogénicité?,
Concepts Clés et Résumé
- Une mutation héréditaire changement dans l’ADN. Une mutation peut entraîner une modification de la séquence d’acides aminés d’une protéine, affectant éventuellement sa fonction.
- une mutation ponctuelle affecte une seule paire de bases. Une mutation ponctuelle peut provoquer une mutation silencieuse si le codon ARNm code pour le même acide aminé, une mutation missense si le codon ARNm code pour un acide aminé différent, ou une mutation non-sens si le codon ARNm devient un codon stop.,
- Les mutations Missense peuvent conserver leur fonction, en fonction de la chimie du nouvel acide aminé et de son emplacement dans la protéine. Les mutations non-sens produisent des protéines tronquées et souvent non fonctionnelles.
- une mutation frameshift résulte d’une insertion ou d’une délétion d’un nombre de nucléotides qui n’est pas un multiple de trois. Le changement de cadre de lecture modifie chaque acide aminé après le point de la mutation et entraîne une protéine non fonctionnelle.
- Les mutations spontanées se produisent par des erreurs de réplication de l’ADN, tandis que les mutations induites se produisent par l’exposition à un mutagène.,
- Les agents mutagènes sont souvent cancérigènes mais pas toujours. Cependant, presque tous les cancérogènes sont mutagènes.
- Les mutagènes chimiques comprennent les analogues de bases et les produits chimiques qui modifient les bases existantes. Dans les deux cas, les mutations sont introduites après plusieurs cycles de réplication de l’ADN.
- Les rayonnements ionisants, tels que les rayons X et les rayons γ, entraînent la rupture de l’épine dorsale phosphodiester de L’ADN et peuvent également modifier chimiquement les bases pour modifier leurs règles d’appariement des bases.,
- Les rayonnements non ionisants comme la lumière ultraviolette peuvent introduire des dimères de pyrimidine (thymine) qui, au cours de la réplication et de la transcription de l’ADN, peuvent introduire des mutations frameshift ou ponctuelles.
- Les cellules ont des mécanismes pour réparer les mutations naturelles. L’ADN polymérase a une activité de relecture. La réparation de non-concordance est un processus pour réparer les bases incorrectement incorporées après que la réplication D’ADN a été accomplie.
- les dimères de Pyrimidine peuvent également être réparés., Dans la réparation de l’excision nucléotidique (réparation sombre), les enzymes reconnaissent la distorsion introduite par le dimère de pyrimidine et remplacent le brin endommagé par les bases correctes, en utilisant le brin D’ADN non endommagé comme modèle. Les bactéries et autres organismes peuvent également utiliser la réparation directe, dans laquelle l’enzyme photolyase, en présence de lumière visible, brise les pyrimidines.
- En comparant la croissance sur la plaque complète et le manque de croissance sur des milieux dépourvus de nutriments spécifiques, des mutants spécifiques de perte de fonction appelés auxotrophes peuvent être identifiés.,
- Le test D’Ames est une méthode peu coûteuse qui utilise des bactéries auxotrophes pour mesurer la mutagénicité d’un composé chimique. Mutagénicité est un indicateur du potentiel cancérogène.
Plusieurs Choix
Lequel des énoncés suivants est un changement dans la séquence qui conduit à la formation d’un codon stop?
- mutation faux-sens
- mutation non-sens
- mutation silencieuse
- mutation par délétion
la formation de dimères de pyrimidine résulte de laquelle des caractéristiques suivantes?
- spontanée des erreurs par l’ADN polymérase
- l’exposition aux rayonnements gamma
- l’exposition aux rayons ultraviolets
- l’exposition à des agents intercalants
lequel des éléments suivants est un exemple de mutation frameshift?
- une suppression d’un codon
- mutation faux-sens
- mutation silencieuse
- suppression d’un nucléotide
quelle est le type de réparation de l’ADN dans lequel les dimères de thymine sont directement brisée par l’enzyme photolyase?,
- direct de réparation
- réparation par excision de nucléotides
- réparation des mésappariements
- relecture
Lequel des énoncés suivants concernant le test d’Ames est vrai?
- Il est utilisé pour identifier nouvellement formé auxotrophe mutants.
- Il est utilisé pour identifier les mutants ayant une activité biosynthétique restaurée.
- Il est utilisé pour identifier les mutants spontanés.,
- Il est utilisé pour identifier les mutants dépourvus d’activité de photoréactivation.
à compléter
Un agent mutagène chimique, qui est structurellement similaire à un nucléotide mais a différents appariement de bases de règles est appelé un ________.,
L’enzyme utilisée dans la lumière de réparation de diviser dimères de thymine est appelé ________.
Le phénotype d’un organisme qui est le plus souvent observée dans la nature est appelé ________.,
Vrai/Faux
les cancérogènes sont généralement mutagènes.
Penser
Pourquoi est-il plus probable que des insertions ou des délétions sera plus préjudiciable à une cellule de mutations ponctuelles?,
pourquoi pensez-vous que le test D’Ames est préférable à l’utilisation de modèles animaux pour dépister la Mutagénicité des composés chimiques?
pensée critique
Voici plusieurs séquences D’ADN qui sont mutées par rapport à la séquence de type sauvage: 3′-T A C T G A C T G A C G A T C-5′. Imaginez que chacun est une section d’une molécule D’ADN qui s’est séparée en préparation pour la transcription, de sorte que vous ne voyez que le brin de modèle., Construisez les séquences D’ADN complémentaires (indiquant les extrémités 5′ et 3′) pour chaque séquence d’ADN mutée, puis transcrivez (indiquant les extrémités 5′ et 3′) les brins de gabarit et traduisez les molécules d’ARNm à l’aide du code génétique, enregistrant la séquence d’acides aminés résultante (indiquant les terminaisons N et C). Quel type de mutation est chacun?,>
séquence d’ADN Complémentaire:
de la séquence de l’arnm transcrit à partir d’un modèle:
séquence d’acides Aminés du peptide:
Type de mutation:
séquence d’ADN Complémentaire:
de la séquence de l’arnm transcrit à partir d’un modèle:
séquence d’acides Aminés du peptide:
Type de mutation: