la façon dont les éléments interagissent les uns avec les autres dépend de la façon dont leurs électrons sont disposés et du nombre d’ouvertures pour les électrons qui existent dans la région ultrapériphérique où les électrons sont présents dans un atome. Les électrons existent à des niveaux d’énergie qui forment des coquilles autour du noyau. La coquille la plus proche peut contenir jusqu’à deux électrons. La coquille la plus proche du noyau est toujours remplie en premier, avant que toute autre coquille puisse être remplie. L’hydrogène a un électron; par conséquent, il n’a qu’une seule tache occupée dans la coquille la plus basse., L’hélium a deux électrons; par conséquent, il peut remplir complètement la coquille la plus basse avec ses deux électrons. Si vous regardez le tableau périodique, vous verrez que l’hydrogène et l’hélium sont les deux seuls éléments de la première ligne. C’est parce qu’ils n’ont que des électrons dans leur première coquille. L’hydrogène et l’hélium sont les deux seuls éléments qui ont la coquille la plus basse et aucune autre coquille.
La deuxième et troisième niveaux d’énergie peut contenir jusqu’à huit électrons. Les huit électrons sont disposés en quatre paires et une position dans chaque paire est remplie d’un électron avant que toutes les paires ne soient terminées.,
en regardant à nouveau le tableau périodique (Figure 1), vous remarquerez qu’il y a sept lignes. Ces lignes correspondent au nombre de shells que les éléments de cette ligne ont. Les éléments d’une ligne particulière ont un nombre croissant d’électrons à mesure que les colonnes vont de gauche à droite. Bien que chaque élément ait le même nombre de coquilles, toutes les coquilles ne sont pas complètement remplies d’électrons. Si vous regardez la deuxième ligne du tableau périodique, vous trouverez le lithium (Li), le béryllium (be), le bore (B), le carbone (C), azote (N), l’oxygène (O), le fluor (F), et le néon (Ne)., Ceux-ci ont tous des électrons qui n’occupent que les première et deuxième coquilles. Le Lithium n’a qu’un électron dans sa coquille la plus externe, le béryllium a deux électrons, le bore en a trois, etc., jusqu’à ce que la coquille entière soit remplie de huit électrons, comme c’est le cas avec le néon.
Tous les éléments n’ont pas assez d’électrons pour remplir leurs coquilles les plus externes, mais un atome est à son plus stable lorsque toutes les positions d’électrons dans la coquille la plus externe sont remplies., En raison de ces lacunes dans les coquilles les plus externes, nous voyons la formation de liaisons chimiques, ou des interactions entre deux ou plusieurs éléments identiques ou différents qui entraînent la formation de molécules. Pour atteindre une plus grande stabilité, les atomes auront tendance à remplir complètement leurs coquilles extérieures et se lieront à d’autres éléments pour atteindre cet objectif en partageant des électrons, en acceptant des électrons d’un autre atome ou en faisant don d’électrons à un autre atome., Parce que les coquilles les plus extérieures des éléments à faible nombre atomique (jusqu’au calcium, de numéro atomique 20) peuvent contenir huit électrons, on parle de règle de l’octet. Un élément peut donner, accepter ou partager des électrons avec d’autres éléments pour remplir son enveloppe extérieure et satisfaire à la règle de l’octet.
Lorsqu’un atome ne contient pas un nombre égal de protons et d’électrons, on l’appelle un ion. Parce que le nombre d’électrons n’est pas égal au nombre de protons, chaque ion a une charge nette. Les ions positifs sont formés en perdant des électrons et sont appelés cations., Les ions négatifs sont formés en gagnant des électrons et sont appelés anions.
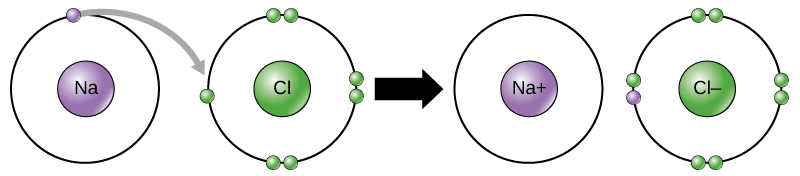
Par exemple, le sodium n’a qu’un électron dans sa coquille la plus externe. Il faut moins d’énergie pour que le sodium donne cet électron que pour accepter sept électrons de plus pour remplir l’enveloppe extérieure. Si le sodium perd un électron, il a maintenant 11 protons et seulement 10 électrons, le laissant avec une charge globale de +1. On l’appelle maintenant un ion sodium.
L’atome de chlore a sept électrons dans sa coquille. Encore une fois, il est plus économe en énergie pour le chlore de gagner un électron que d’en perdre sept., Par conséquent, il a tendance à gagner un électron pour créer un ion avec 17 protons et 18 électrons, ce qui lui donne une charge négative nette (-1). On l’appelle maintenant un ion chlorure. Ce mouvement d’électrons d’un élément à un autre est appelé transfert d’électrons. Comme l’illustre la Figure 1, un atome de sodium (Na) n’a qu’un électron dans sa coquille la plus externe, alors qu’un atome de chlore (Cl) a sept électrons dans sa coquille la plus externe. Un atome de sodium donnera son électron pour vider sa coquille, et un atome de chlore acceptera cet électron pour remplir sa coquille, devenant chlorure., Les deux ions satisfont maintenant à la règle de l’octet et ont des coquilles extérieures complètes. Parce que le nombre d’électrons n’est plus égal au nombre de protons, chacun est maintenant un ion et a une charge de +1 (sodium) ou -1 (chlorure).

Ionique Liens
Il y a quatre types d’obligations ou des interactions ioniques, covalentes, liaisons hydrogène, interactions de van der Waals. Les liaisons ioniques et covalentes sont des interactions fortes qui nécessitent un apport d’énergie plus important pour se séparer. Lorsqu’un élément donne un électron de son enveloppe extérieure, comme dans l’exemple d’atome de sodium ci-dessus, un ion positif est formé (Figure 2). L’élément acceptant l’électron est maintenant chargé négativement., Parce que les charges positives et négatives attirent, ces ions restent ensemble et forment une liaison ionique, ou une liaison entre les ions. Les éléments se lient avec l’électron d’un élément restant principalement avec l’autre élément. Lorsque les ions Na+ et Cl– se combinent pour produire du NaCl, un électron d’un atome de sodium reste avec les sept autres de l’atome de chlore, et les ions sodium et chlorure s’attirent dans un réseau d’ions avec une charge nette nulle.,
liaisons covalentes
Un autre type de liaison chimique forte entre deux atomes ou plus est une liaison covalente. Ces liaisons se forment lorsqu’un électron est partagé entre deux éléments et constituent la forme de liaison chimique la plus forte et la plus courante chez les organismes vivants. Des liaisons covalentes entre les éléments qui composent les molécules biologiques dans nos cellules., Contrairement aux liaisons ioniques, les liaisons covalentes ne se dissocient pas dans l’eau.
fait intéressant, les chimistes et les biologistes mesurent la force de liaison de différentes manières. Les chimistes mesurent la force absolue d’une liaison (la force théorique) tandis que les biologistes s’intéressent davantage à la façon dont la liaison se comporte dans un système biologique, qui est généralement aqueux (à base d’eau). Dans l’eau, les liaisons ioniques se séparent beaucoup plus facilement que les liaisons covalentes, de sorte que les biologistes diraient qu’elles sont plus faibles que les liaisons covalentes. Si vous regardez dans un manuel de chimie, vous verrez quelque chose de différent., C’est un excellent exemple de la façon dont la même information peut conduire à des réponses différentes en fonction de la perspective à partir de laquelle vous la visualisez.
Les atomes d’hydrogène et d’oxygène qui se combinent pour former des molécules d’eau sont liés par des liaisons covalentes. L’électron de l’atome d’hydrogène divise son temps entre la coque extérieure de l’atome d’hydrogène et l’incomplétude de l’enveloppe externe de l’atome d’oxygène. Pour remplir complètement l’enveloppe extérieure d’un atome d’oxygène, deux électrons de deux atomes d’hydrogène sont nécessaires, d’où l’indice « 2” dans H2O., Les électrons sont partagés entre les atomes, divisant leur temps entre eux pour « remplir” l’enveloppe extérieure de chacun. Ce partage est un État d’énergie plus faible pour tous les atomes impliqués que s’ils existaient sans leur enveloppe extérieure remplie.
Il existe deux types de liaisons covalentes: polaire et non polaire. Des liaisons covalentes non polaires se forment entre deux atomes du même élément ou entre différents éléments qui partagent les électrons de manière égale. Par exemple, un atome d’oxygène peut se lier avec un autre atome d’oxygène pour remplir leurs coquilles., Cette association est non polaire car les électrons seront également répartis entre chaque atome d’oxygène. Deux liaisons covalentes se forment entre les deux atomes d’oxygène car l’oxygène a besoin de deux électrons partagés pour remplir sa coquille la plus externe. Les atomes d’azote formeront trois liaisons covalentes (également appelées Triple covalentes) entre deux atomes d’azote car chaque atome d’azote a besoin de trois électrons pour remplir sa coquille la plus externe. Un autre exemple de liaison covalente non polaire se trouve dans la molécule de méthane (CH4). L’atome de carbone a quatre électrons dans sa coquille la plus externe et a besoin de quatre autres pour le remplir., Il obtient ces quatre à partir de quatre atomes d’hydrogène, chaque atome en fournissant un. Ces éléments partagent tous les électrons de manière égale, créant quatre liaisons covalentes non polaires (Figure 3).
dans une liaison covalente polaire, les électrons partagés par les atomes passent plus de temps plus près d’un noyau que de l’autre noyau. En raison de la répartition inégale des électrons entre les différents noyaux, une charge légèrement positive (δ+) ou légèrement négative (δ–) se développe. Les liaisons covalentes entre les atomes d’hydrogène et d’oxygène dans l’eau sont des liaisons covalentes polaires., Les électrons partagés passent plus de temps près du noyau d’oxygène, lui donnant une petite charge négative, qu’ils ne passent près des noyaux d’hydrogène, donnant à ces molécules une petite charge positive.

des liaisons Hydrogène
les liaisons Ioniques et covalentes sont des liens forts qui nécessitent beaucoup d’énergie à la pause. Cependant, toutes les liaisons entre les éléments ne sont pas des liaisons ioniques ou covalentes. Des liens plus faibles peuvent également se former. Ce sont des attractions qui se produisent entre des charges positives et négatives qui ne nécessitent pas beaucoup d’énergie pour se briser. Deux liaisons faibles qui se produisent fréquemment sont les liaisons hydrogène et les interactions de van der Waals. Ces liaisons donnent naissance aux propriétés uniques de l’eau et aux structures uniques de L’ADN et des protéines.,
lorsque des liaisons covalentes polaires contenant un atome d’hydrogène se forment, l’atome d’hydrogène dans cette liaison a une charge légèrement positive. C’est parce que l’électron partagé est tiré plus fortement vers l’autre élément et loin du noyau d’hydrogène. Parce que l’atome d’hydrogène est légèrement positif (δ+), il sera attiré par les charges partielles négatives voisines (δ–). Lorsque cela se produit, une faible interaction se produit entre le δ+ charge de l’atome d’hydrogène d’une molécule et la δ– responsable de l’autre molécule. Cette interaction s’appelle une liaison hydrogène., Ce type de liaison est courant; par exemple, la nature liquide de l’eau est causée par les liaisons hydrogène entre les molécules d’eau (Figure 4). Les liaisons hydrogène confèrent à l’eau les propriétés uniques qui soutiennent la vie. Si il n’y avait pas de liaison hydrogène, l’eau serait un gaz plutôt qu’un liquide à la température ambiante.

liaisons Hydrogène peut se former entre les différentes molécules et ils n’ont pas toujours d’inclure une molécule d’eau. Les atomes d’hydrogène dans les liaisons polaires dans n’importe quelle molécule peuvent former des liaisons avec d’autres molécules adjacentes. Par exemple, les liaisons hydrogène maintiennent ensemble deux longs brins d’ADN pour donner à la molécule D’ADN sa structure double brin caractéristique. Liaisons hydrogène sont aussi responsables de la structure tridimensionnelle des protéines.,
Interactions de van der Waals
comme les liaisons hydrogène, les interactions de van der Waals sont de faibles attractions ou interactions entre molécules. Ils se produisent entre des atomes polaires liés de manière covalente dans différentes molécules. Certaines de ces attractions faibles sont causées par des charges partielles temporaires formées lorsque les électrons se déplacent autour d’un noyau. Ces faibles interactions entre molécules sont importantes dans les systèmes biologiques.