a genotípus és a fenotípus közötti kapcsolatok tanulmányozása során fontos megvizsgálni a fenotípusok statisztikai előfordulását az ismert genotípusok egy csoportjában., Más szavakkal, mivel egy adott tulajdonság ismert genotípusainak egy csoportja van, hány azonos genotípus mutatja a kapcsolódó fenotípust? Lehet, hogy meglepett, hogy megtanulják, hogy bizonyos tulajdonságok, a fenotípus nem fordulhat elő olyan gyakran, mint a genotípus. Például, mondjuk mindenki populáció w hordozza ugyanazt allél kombinációk egy bizonyos tulajdonság, még csak 85% – át a lakosság ténylegesen mutatja a fenotípus várható e allél kombinációk. A genotípusok azon arányát, amelyek ténylegesen a várható fenotípusokat mutatják, penetranciának nevezik. Így az előző példában a penetrancia 85%., Ezt az értéket olyan populációk vizsgálatából számítják ki, amelyek genotípusait ismerjük.
valójában nagy populációs vizsgálatokra van szükség a penetrancia méréséhez, és a penetrancia vizsgálata segít megjósolni, hogy mennyire valószínű, hogy egy tulajdonság nyilvánvaló lesz azokban, akik a mögöttes allélokat hordozzák. Általában, amikor tudjuk, hogy a genotípus jelen van, de a fenotípus nem megfigyelhető, a tulajdonság hiányos penetrációt mutat. Alapvetően bármi, ami kevesebb, mint 100% penetranciát mutat, a hiányos penetráció példája., Ezért, bár egy tulajdonság penetrációja statisztikailag kiszámított érték, amely egy fenotípus megjelenésén alapul az ismert genotípusok között, a hiányos penetráció egyszerűen egy kvalitatív leírás az ismert genotípusok egy csoportjáról.
a hiányos penetráció konkrét példája az osteogenesis imperfecta (OI) humán csontbetegség. A betegségben szenvedők többsége domináns mutációval rendelkezik az 1.típusú kollagént, a COL1A1-et vagy a COL1A2-t előállító két gén egyikében. A kollagén olyan szövet, amely erősíti a csontokat és az izmokat, valamint több testszövetet., Az emberek OI gyenge csontok, kékes színű a szemük fehérjét, valamint a különböző megpróbáltatásokat, mert gyenge az ízületek, illetve a fogak. Ez a betegség azonban nem érinti mindazokat, akiknek a COLIA1 és COLIA2 mutációi ugyanúgy vannak. Valójában néhány ember hordozhatja a mutációt, de nincsenek tünetei. Így a családok tudatlanul továbbíthatják a mutációt egyik generációról a másikra olyan személyen keresztül, aki hordozza a mutációt, de nem fejezi ki az OI fenotípust.,
az olyan hiányos penetrációs példák, mint például az OI, azt mutatják, hogy még a monogén betegségek sem rendelkeznek kiszámítható expressziós mintákkal egy populációban. Van-e mód megmagyarázni ezt a kiszámíthatatlanságot? Gondoljunk bele. Ha két embernek ugyanaz a domináns mutációja van a COL1A1-ben, miért csak egyikük mutathat OI tüneteket? Lehet, hogy köze van más génekhez, amelyek megmentik a mutált kollagén gén rossz hatását? Lehet, hogy azok, akiknek OI-je van, egyszerűen mutált kollagént fejeznek ki, mint az a személy, akit nem érint?, Ahhoz, hogy megvizsgáljuk a hiányos penetráció lehetséges magyarázatait, emlékeznünk kell arra, hogy hány lépés van a gén transzkripciója és a fehérje expressziója között.
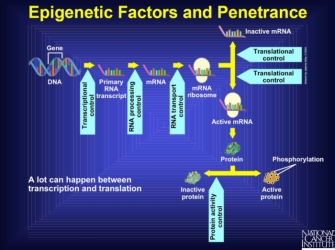
vegye figyelembe, hogy más gének, például transzkripciós vagy transzlációs szabályozók expressziója befolyásolhatja egy géntermék végső hatását. Bármi, ami zavarja a transzkripciótól a fehérje aktiválásig vezető utat, epigenetikai tényezőként ismert. Valójában több olyan pont van, ahol egy másik géntermék beavatkozhat a fehérje termelését megelőző szakaszokba., Az interferencia ezekben a szakaszokban teljesen leállíthatja a termelést, a fehérje megváltozott formáját hozhatja létre, amely soha nem lehet aktív, vagy bármilyen más dolgot, ami a gént hallgatja. Tehát az aktív fehérje végső fázisa sok különböző folyamatot tükröz, amelyek az aminosav szekvenciához és a végső fehérje alakjához vezetnek, amelyek mindegyikét más gének is megzavarhatják. Ezenkívül egyes gének felfelé vagy lefelé szabályozhatják a transzkripció sebességét, ami megváltoztatja a termelt fehérje teljes mennyiségét., Így azok a gének, amelyek befolyásolják egy másik gén végső formáját és expressziós mennyiségét, befolyásolhatják a szabályozott génből származó fenotípus kialakulását (1.ábra).
tehát, ha olyan sok különböző lehetséges módosítási pont létezik egy géntermék esetében, hogyan szűkíthetjük le azt a kérdést, hogy mi okozza a hiányos penetrációt? Érdekes, hogy egyes tudósok valóban megpróbálták ezt megtenni azáltal, hogy megfigyelik, hogy az OI-t okozó genetikai mutációk hogyan befolyásolják az egereket. Ezek a kutatók a COL1A1 mutált formáját egerekbe ültették, és úgy tenyésztették őket, hogy mind tartalmazták ezt a mutációt., Az egereket hasonló módon érintették, mint a humán OI-t: sokuknak súlyos csontgyengesége és többszörös csonttörése volt, még születéskor is. Valójában, amikor a kutatók szorosan megvizsgálták az egér csontjait, azt találták, hogy a mutált COL1A1 génnel rendelkező egerek 70% – a OI-t mutatott (csonttörések); a fennmaradó 30% azonban teljesen normálisnak tűnt. Ezekben az Oi fenotípus nélküli egerekben ugyanolyan mennyiségű COL1A1 expresszió volt, mint azokban az egerekben, amelyek a fenotípust mutatták., Továbbá, a kutatók egy fajtatiszta egér törzset használtak, amelynek kezdetben kevés variabilitása volt a genomjukban. Ez azt jelenti, hogy a genetikai kontextus, amelyben a COL1A1-et kifejezték, nem változott a vizsgált egerek között. Mégis, annak ellenére, hogy az egerek rendkívül hasonló genomokkal rendelkeztek, és mindegyik ugyanolyan mennyiségű COL1A1-et fejezett ki, 30% – uk nem mutatott OI-fenotípust. Ezek az eredmények továbbra is zavarba ejtőek.
ezért még a jelenleg rendelkezésre álló erőteljes Kísérleti technikák sem tudják megmagyarázni a penetranciát., A hiányos penetráció, a genetikai háttér és a változó expressziós szintek két legnépszerűbb magyarázata nem magyarázta a fenotípus hiányát az egerek 30% – ában (Pereira et al., 1994).