Im vorherigen Beitrag haben wir ortho -, Para-und Meta-Direktoren in der elektrophilen aromatischen Substitution eingeführt. Zuvor haben wir den Mechanismus der elektrophilen aromatischen Substitution behandelt und gezeigt, dass der Mechanismus durch ein Carbokationszwischenprodukt verläuft.,
Heute werden wir diese beiden Konzepte miteinander verbinden und versuchen zu zeigen, ob ein Substituent ein Ortho -, Para – oder Metadirektor ist, hängt davon ab, wie der Substituent die Stabilität des Carbocation – Intermediates beeinflusst.
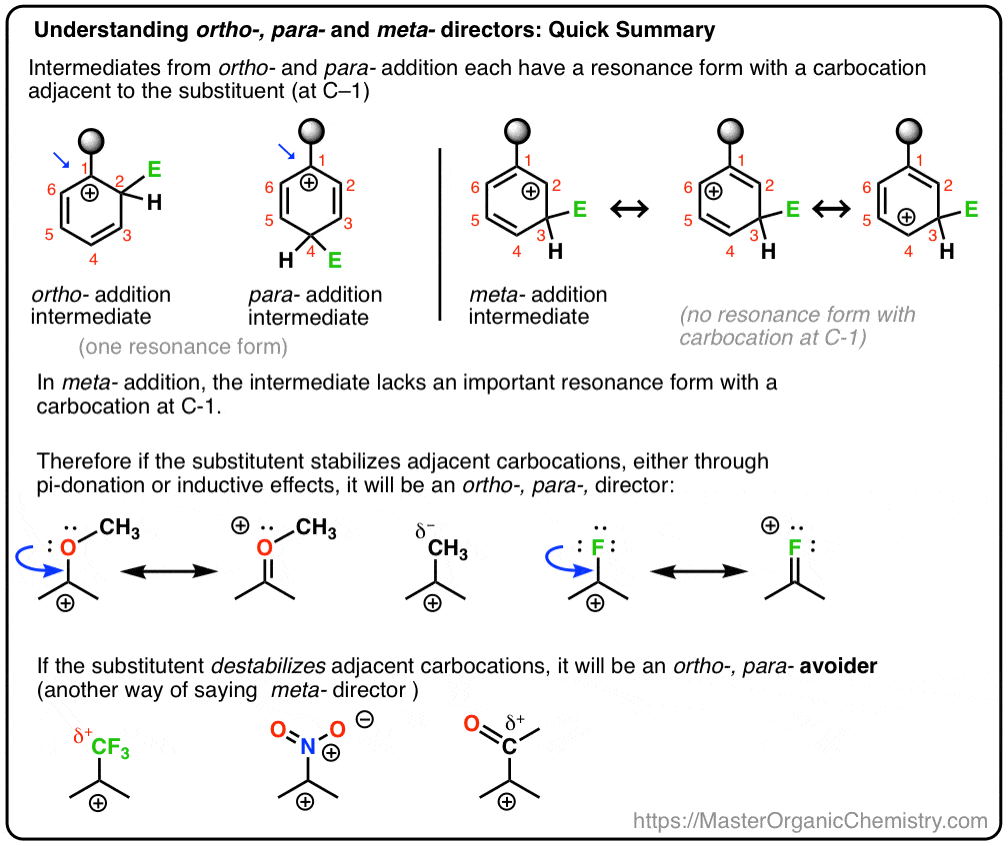
Und wir werden auch sehen, warum ein alternativer Name für Meta – Director“ortho-, para – avoider“ sein könnte. :- )
Inhaltsverzeichnis
- Carbokationen Werden Durch Benachbarte Atome Mit Einsamen Paaren Stabilisiert
- Fallstudie #1: Ein Ortho -, Para-Direktor (OCH3)
- Ja, Sauerstoff Ist Elektronegativ., Aber Die Spende Seines Einsamen Paares Macht Es Mehr Als Wett!
- Die Reaktion Energie Diagramm Für Ein Ortho-Para-Leiter
- Case Study #2: A meta – Direktor (CF3).
- Was Wir „Meta– Direktoren“ Nennen, Sind Eher „Ortho–, Para-Avoider“
- Das Reaktionsenergiediagramm Für Einen Meta – Direktor
- Warum Sind Halogene Ortho -, Para-Direktoren?
- Notizen
- Quiz selbst!,
- (Fortgeschrittene) Referenzen und Weiterlesen
Carbokationen werden durch benachbarte Atome mit einsamen Paaren stabilisiert
Denken wir zurück, welche Faktoren die Stabilität von Carbokationen erhöhen.
Carbokationen sind elektronenarme Spezies mit sechs Elektronen in ihrer Valenzschale. Also, jeder Substituent, der die Elektronendichte in Richtung der Carbokation spenden kann, wird sich stabilisieren. Dazu gehören:
- elektronenfreisetzende Substituenten, die als „Sigma-Spender“ fungieren können (z., viele Alkylgruppen, die Elektronendichte durch induktive Effekte spenden)
- benachbarte Atome mit einsamen Paaren, die als „pi–Spender“ für die Carbokation wirken können
- benachbarte C-C-pi-Bindungen, die die Carbokation durch Ladungsdelokalisierung stabilisieren können („Resonanzstabilisierung“, mit anderen Worten).
Und Faktoren, die Carbokationen destabilisieren?
- jeder Substituent, der die Elektronendichte aus einer Carbokation entfernt, z. B. starke elektronenrückziehende Gruppen.
Also hier ist ein kurzes Quiz., Welche der beiden folgenden Carbokationen wird angesichts allem, was oben geschrieben steht, stabiler sein?
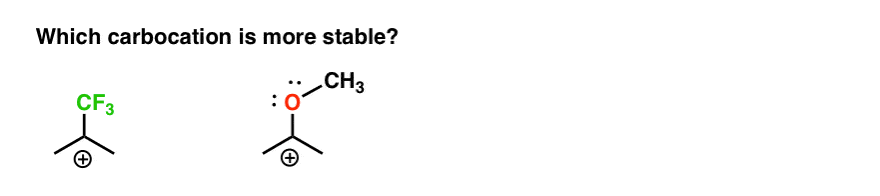
Wenn Sie diese Frage gut beantworten können, können Sie den Unterschied zwischen Ortho-, Para – und Meta – Direktoren am besten verstehen.
Untersuchen wir zwei Fallstudien. Wir werden uns eine generische elektrophile aromatische Substitutionsreaktion von Benzol mit einem Ortho-, Para – Direktor (Methoxybenzol) ansehen und die Zwischenprodukte untersuchen, die durch Angriff an den Ortho -, Meta-und Para-Positionen erhalten werden., Dann führen wir die gleiche Übung mit einem Meta– Direktor (Tetrahydomethylbenzol) durch.
Dabei hoffen wir zu verstehen, warum Methoxybenzol Ortho – und Para– Produkte bevorzugt, während Fluormethylbenzol das Metaprodukt bevorzugt.
Fallstudie #1: Eine ortho -, Para – und (OCH3)
Elektrophile aromatische Substitution von Methoxybenzol führt tendenziell zu Ortho – und Para – Produkten mit sehr wenig Meta -., Hier ist, was in der Nitrierung passiert, zum Beispiel:
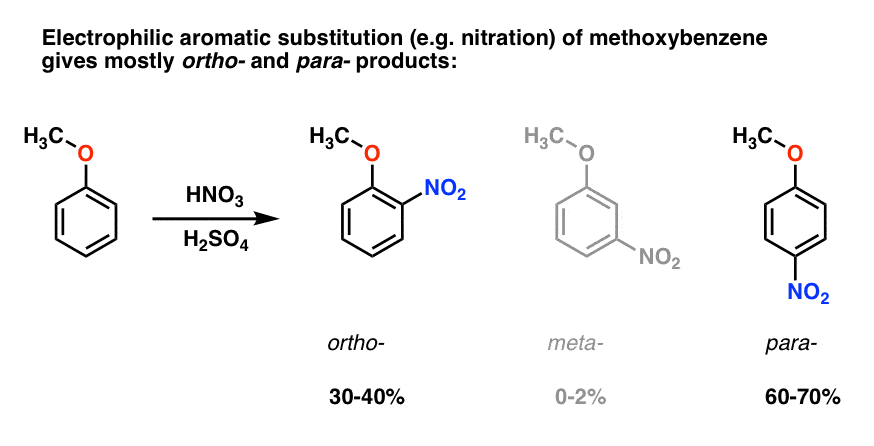
Das Para – Produkt dominiert (60-70%), mit Ortho – close hinter (30-40%) und nur eine Spur des Meta– .
Warum?
3. Ja, Sauerstoff Ist Elektronegativ. Aber Die Spende Seines Einsamen Paares Macht Es Mehr Als Wett!
Hier ist der Weg zum ortho – Produkt., Wir brechen eine C–C-pi-Bindung und bilden eine neue C-E-Bindung (wobei E ein generisches Elektrophil darstellen soll), wodurch eine resonanzstabilisierte Carbokation erzeugt wird:
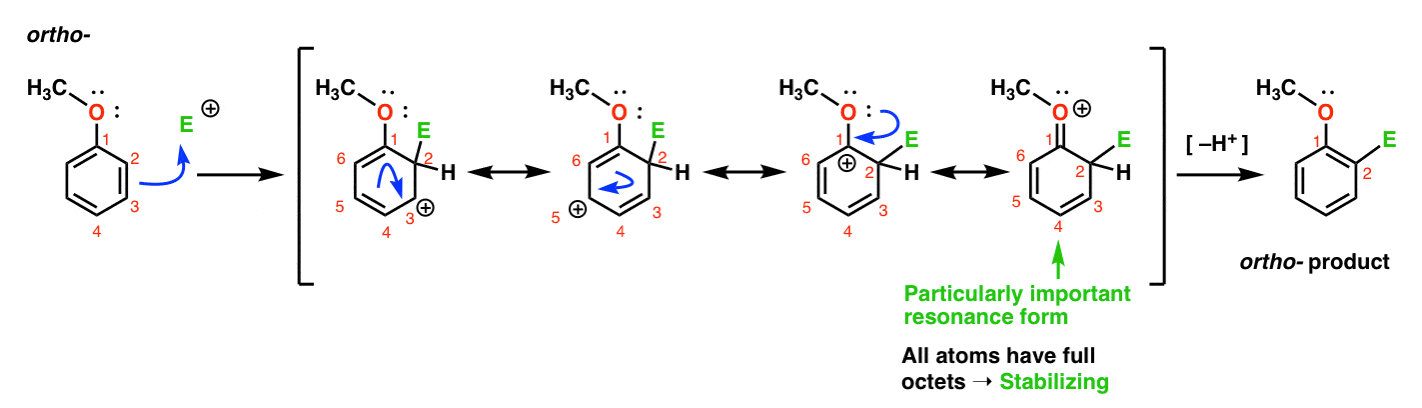
Wenn Sie genau hinsehen, sollten Sie beachten, dass wir vier Resonanzformen bilden können . Drei von ihnen tragen volle Carbokationen (auf C1, C3 und C5), aber es ist die vierte – die Resonanzform, bei der es eine C=O pi – Bindung gibt-was besonders wichtig ist. Warum? In dieser Resonanzform haben alle Kohlenstoffatome ein volles Oktett von Elektronen., Das liegt daran, dass der Sauerstoff, der direkt mit dem Ring verbunden ist, ein einsames Paar an den benachbarten Carbocation spenden kann und eine Pi-Bindung bildet. Dies ist ein Beispiel für eine Spende.
Hier ist der Weg zum Angriff des Elektrophils an der Meta-Position. Beachten Sie den Unterschied!
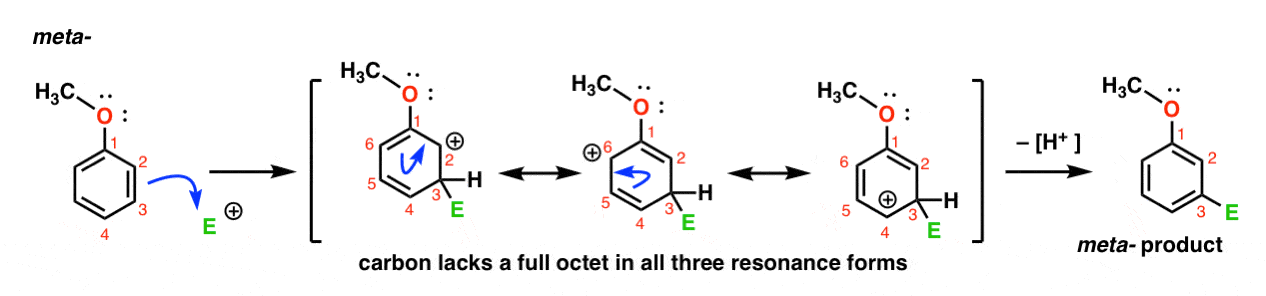
Der Angriff des Elektrophils bei C-3 führt zu einer Carbokation, die über Resonanz auf C2, C4 und C6 delokalisiert werden kann. Es gibt jedoch keine Möglichkeit, die Carbokation auf C1 zu“ verschieben“, was bedeutet, dass es keine vernünftige Resonanzform gibt, in der alle Atome volle Oktette haben.,
Dadurch ist das Meta – Carbocation-Intermediat wesentlich weniger stabil als das Ortho-Carbocation-Intermediat.
Schließlich ist hier die Reaktion, die zum Paraprodukt führt:
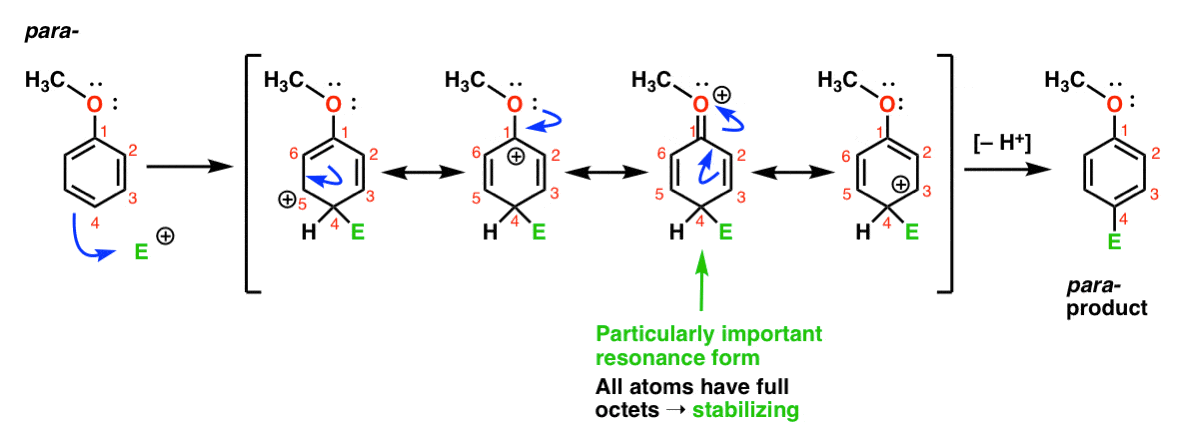
Hier können wir wieder Resonanzformen mit Carbokationen auf C1, C3 und C5 sowie eine vierte Resonanzform zeichnen, bei der das angehängte Sauerstoffatom ein Elektronenpaar an die Carbokation auf C1 spendet, was zu einem vollen Oktett bei Kohlenstoff führt. Dies ist eine Situation, die im Wesentlichen der des Ortho – Intermediates entspricht.,
Durch die Analyse der Resonanzformen (und markieren Sie mein Wort, Sie können in naher Zukunft möglicherweise aufgefordert werden, dasselbe bei einem Test zu tun) können wir feststellen, dass die intermediären Carbokationen, die sich aus der Ortho – und Para– Addition ergeben, erheblich stabiler sind als das Zwischenprodukt aus der Meta– Addition.
Dies erklärt, warum Ortho – und Para-Produkte dominieren und das Metaprodukt geringfügig ist.
Es kann hilfreich sein, dies durch Zeichnen eines Reaktionsenergiediagramms zu visualisieren.
4., Das Reaktionsenergiediagramm Für einen Ortho-Para-Addition
Der zu den Ortho – und Para – Additionsprodukten führende Übergangszustand ist in der Energie viel niedriger als das Meta– .
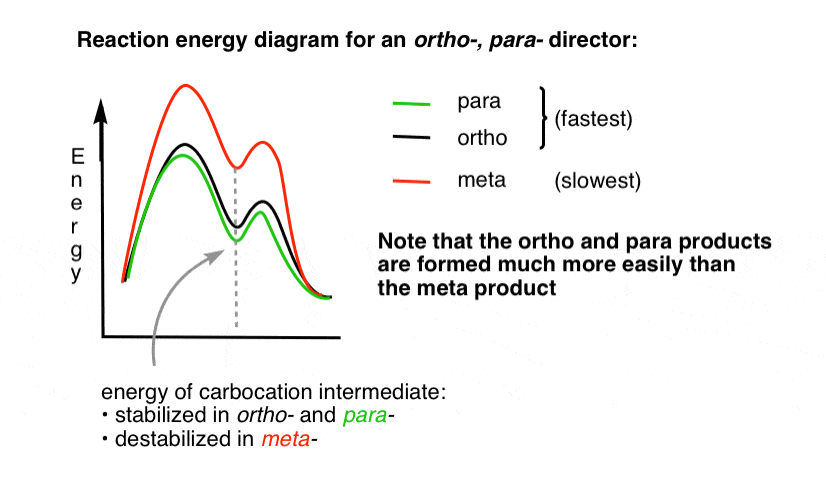
Eine Frage – warum denken Sie, dass Para – bevorzugt werden könnte (zB 60% -70% Ausbeute für das Para– Produkt der Nitrierung, oben, gegenüber 30-40% für Ortho -), obwohl es zwei Ortho – Positionen und nur eine Para- ?
Denken Sie eine Minute darüber nach, und wir werden es unten ansprechen.
5. Fallstudie #2: Ein Meta-Direktor (CF3).
Also was ist mit CF3?, Warum gibt es meta – Produkte? Lassen Sie uns die gleiche Art von Analyse durchführen.
Hier ist der Weg zum ortho – Produkt. Wie beim Ortho – Intermediate oben können wir drei Resonanzformen zeichnen, die die Carbokation auf C1, C3 bzw.
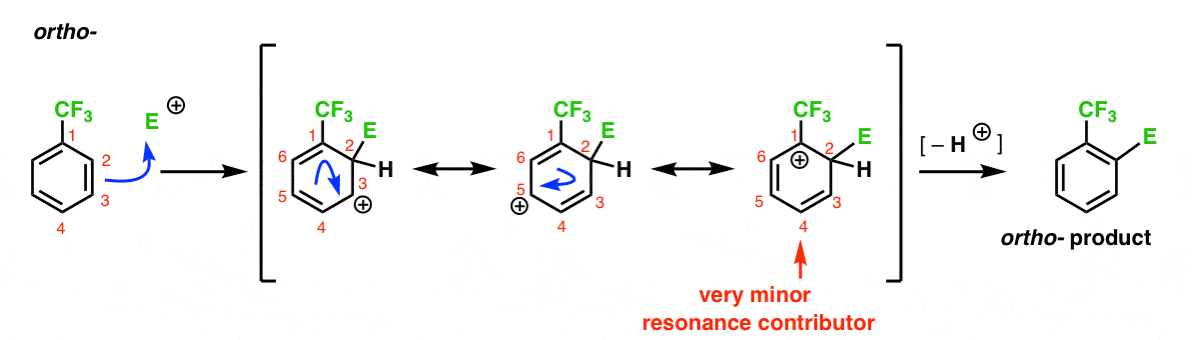
Was ist in diesem Fall anders?
Anders ist das Vorhandensein einer starken Elektronenrückzugsgruppe (CF3) bei C1, was das Ballspiel komplett verändert.
Wie gesagt, Carbokationen werden durch Nachbarn destabilisiert, die die Elektronendichte zurückziehen., Daher würden wir erwarten, dass dies ein sehr geringer Resonanzfaktor ist, mit dem Ergebnis, dass die positive Ladung nur über C3 und C5 delokalisiert wird.
Wir haben festgestellt, dass CF3 ein Meta-Director ist. Es ist vernünftig zu denken, dass es etwas über das Meta gibt– das macht es besonders stabil. Können Sie durch die Analyse des Zwischenwerts für das Metaprodukt unten sehen, warum?
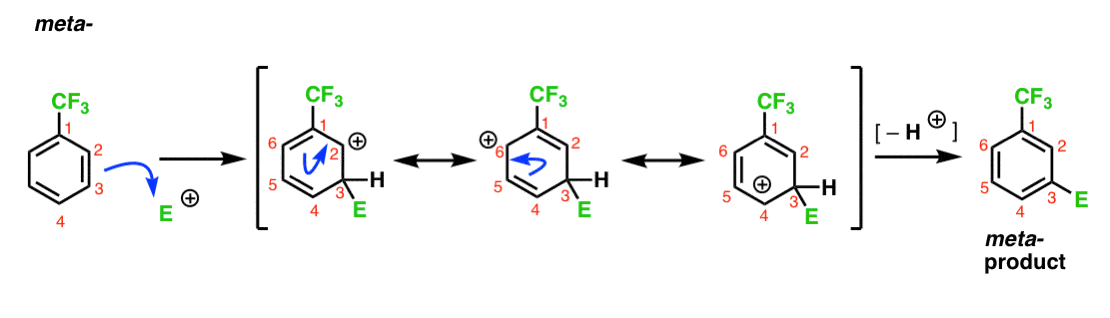
Hmmm. Es gibt keinen Ort, an dem ein Kohlenstoff ein volles Oktett hat. Es gibt keine besonders stabilen Resonanzformen.
Es ist eine Art „meh“, nicht wahr?
6., Was wir „Meta– Direktoren“ nennen, sind eher „Ortho -, Para– Avoider“
Andererseits gibt es auch keine besonders instabilen Resonanzformen. Da die positive Ladung auf C2, C4 und C6 lokalisiert ist, wird eine Situation vermieden, in der die positive Ladung direkt neben der Elektronen zurückziehenden CF3-Gruppe liegt. Und die positive Ladung wird somit im gesamten Ring gut delokalisiert, anders als in der Ortho – Situation oben.
Es ist also ein „weniger schlechtes“ Zwischenprodukt als das Ortho-.,
Schließlich hat das Para-Intermediat das gleiche Problem wie das Ortho -; ein Intermediat mit einer positiven Ladung auf C1, angrenzend an das CF3.
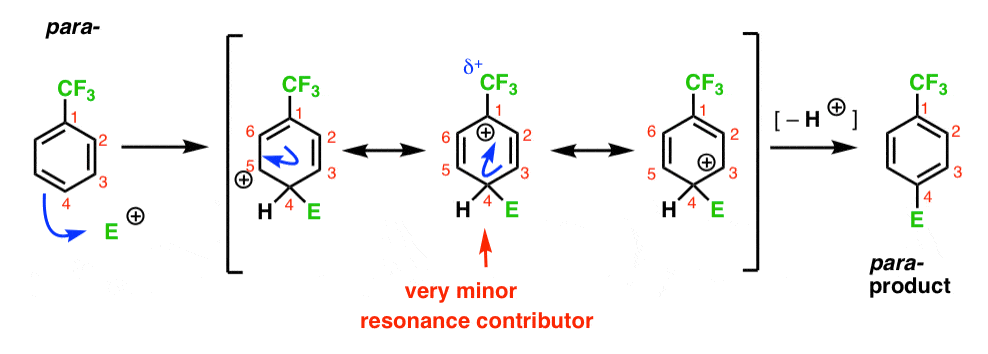
Dadurch ergeben sich nur zwei wichtige Resonanzformen, was zu einem weniger delokalisierten (und damit weniger stabilen) Carbokationszwischenprodukt führt.
Fazit: Das Meta carbocation Intermediate ist stabiler als entweder die Ortho-oder die Para-Intermediate.
Aber es liegt nicht daran, dass der Substituent selbst eine stabilisierende Wirkung auf das Meta– Intermediat hat. .,
Ich würde argumentieren, dass es hilfreicher ist, das Meta als weniger instabil als das Ortho – und Para – zu betrachten .
Auf diese Weise ist es nicht so sehr, dass CF3 ein Meta-Director ist , sondern ein „Ortho–, Para– Avoider. „
7. Das Reaktionsenergiediagramm für einen Meta-Direktor
Hier ist eine Skizze des Reaktionsenergiediagramms:
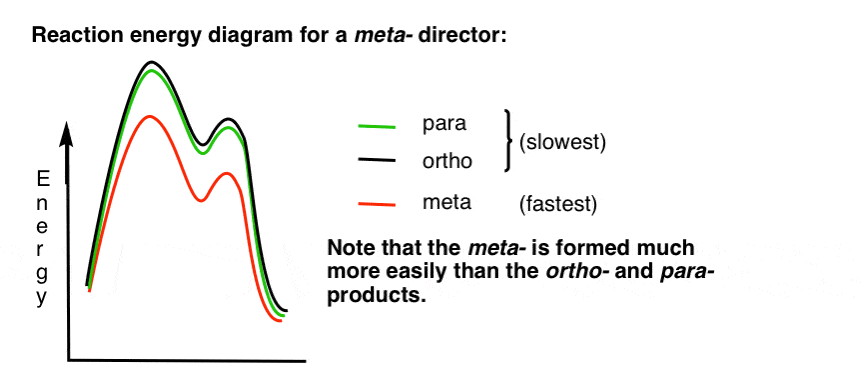
In Ordnung.
Zurück zu unserer ursprünglichen Frage. Welche Carbocation ist also stabiler?,
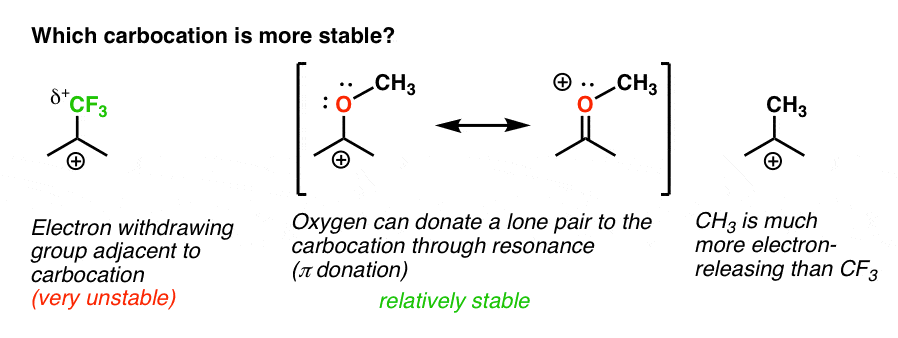
Offensichtlich ist die Carbokation mit einem benachbarten Sauerstoff, der ein einsames Paar trägt, weitaus stabiler als eine Carbokation, die an eine elektronenabziehende Gruppe wie CF3 angrenzt.
Und das beinhaltet den Unterschied zwischen einem Ortho-, Para – Director wie CF3 und einem Meta – Director wie CF3.
Es ist erwähnenswert, dass die meisten Alkylgruppen (wie CH3 ) kein einsames Paar haben, aber immer noch ortho -, Para – Direktoren sind., Dies steht im Einklang mit allem, was wir zuvor darüber gelernt haben, wie Alkylgruppen sich im Allgemeinen für Carbokationen stabilisieren-denken Sie daran, dass die Carbokationsstabilität im Allgemeinen mit Substitution zunimmt
Also über diese Para-Produkte…
Warum werden Para-Produkte mit einer höheren Rate als Ortho-produziert ?
Die Antwort ist sterisches Hindernis.
Angriff an der Para-Position wird durch den Substituenten weniger belastet als Angriff an den Ortho – Positionen sind.
Warum Sind Halogene Ortho-, Para – Direktoren?
Dies lässt uns das etwas knifflige Beispiel von Halogenen.,
Warum sind Fluor, Chlor, Brom und Jod ortho -, Para – Direktoren, obwohl sie Gruppen deaktivieren?
Die Antwort sollte keine Überraschung sein, wenn Sie gefolgt sind, aber wir werden dies bis zum nächsten Beitrag belassen, da dieser bereits lang genug ist.
Nächster Beitrag: Warum sind Halogene ortho-, para – Direktoren?
Hinweise
Hinweis 1. Es ist richtiger zu sagen, dass Ortho-und Para-Produkte dominieren, weil die Übergangszustände, die zu diesen Produkten führen, weniger Energie enthalten als die Energien der Zwischenprodukte selbst., Schließlich ist es die Energie der Übergangszustände, die die Aktivierungsbarriere und damit die Reaktionsgeschwindigkeit bestimmt.
Anmerkung 2. Oder Hyperkonjugation, die die meisten Lehrbücher (mit der bemerkenswerten Ausnahme von Maitland Jones) im Allgemeinen vermeiden.
Quiz!,/div>
 Click to Flip
Click to Flip

 Click to Flip
Click to Flip 
(Erweiterte) Referenzen und Weitere Lesen
- A., F. Holleman, Die direkte Einführung von Substituenten in den Benzolkern
Rec. Trav. Chim. Pays-Bas 1910, 12, 455-456
DOI: 10.1002/recl.19100291205
A. F Holleman von 1910 sagte, dass Ortho-Para-Orientierung mit Aktivierung und Meta-Orientierung mit Deaktivierung verbunden ist. - – Die Art des alternierenden Effekts in Kohlenstoffketten. Teil XXIII. Anomale Orientierung durch Halogene und ihre Auswirkung auf das Problem des Ortho–Para-Verhältnisses in aromatischer Substitution
Christopher Kelk Ingold und Charles Cyril Norrey Vass
J. Chem. Soc. 1928, 417-425
DOI: 10.,1039 / JR9280000417
Dieses Papier diskutiert Richtwirkung in 1,2-Dihalobenzene. - Einige Beobachtungen bezüglich der sterischen Behinderung und der Auswirkungen von Substituenten auf das Ortho : para-Verhältnis bei aromatischer Substitution
P. B. D. de la Mare
J. Chem. Soc. 1949, 2871-2874
DOI: 10.1039 / JR9490002871
De la Mare diskutiert in diesem Artikel verschiedene Faktoren, die für eine Vorherrschaft von para über Ortho-Selektivität verantwortlich sein können, nachdem die Ausbeute des Orthoprodukts durch 2 geteilt wurde (da es 2 Ortho-Positionen gibt, aber nur 1 Para-Position in monosubstituierten Benzinen)., - Volumeneffekte von Alkylgruppen in aromatischen Verbindungen. Teil V. Die monosulphonation von p-Cymen
R. J. W. Le Fèvre
J. Chem. Soc. 1934, 1501-1502
DOI: 10.1039 / JR9340001501
In p-Cymen ist das Hauptprodukt, das bei elektrophiler Sulfonierung erhalten wird, das 2-Produkt (Ortho zur Methylgruppe), wahrscheinlich aufgrund von Sterika. - Effekte der Alkyl-Gruppen in Elektrophile Additions-und Substitutions –
COHN, H., HUGHES, E., JONES, M., PEELING, M. G.
Natur 1952, 169, 291
DOI: 1038/169291a0
Dieses Papier hat Daten zum Vergleich der Nitrierung von t-butylbenzol und Toluol., T-Butylbenzol ist viel p-direktiver als Toluol (79,5% para für T-Butylbenzol vs. 40% para für Toluol), was wahrscheinlich auf Sterika zurückzuführen ist (Ortho-Ansatz wird durch die sperrigere T-Butyl-Gruppe blockiert). - Verteilung von Isomeren in der Mononitration von Ethyl-und Isopropylbenzol. Ein weiterer Beweis für eine Sterische Effekt Isomer Distribution
Herbert C. Brown und W. Hallam Bonner
Journal of the American Chemical Society 1954, 76 (2), 605-606
DOI: 10.,1021 / ja01631a084
Tabelle II in diesem Papier zeigt, dass das Orthoprodukt, das durch Nitrierung von Monoalkylbenzolen erhalten wird, abnimmt, wenn die Alkylgruppe größer wird (z. B. ergibt t-Butylbenzol bei Nitrierung sehr wenig Orthoprodukt im Vergleich zu Toluol). - – Die Art des alternierenden Effekts in Kohlenstoffketten. Teil XXII. Ein weiterer Versuch, den wahrscheinlichen Mechanismus der Orientierung in der aromatischen Substitution zu definieren
Christopher Kelk Ingold und Florence Ruth Shaw
J. Chem. Soc. 1927, 2918-2926
DOI: 10.,1039 / JR9270002918
Ein früher Beitrag des einflussreichen physikalisch-organischen Chemikers Prof. C. K. Ingold besagt, dass Halogenbenzole induktiv elektronentziehend, aber gleichzeitig resonanzstabilisierend sind. - Die anomale Reaktivität von Fluorbenzol in elektrophilen aromatischen Substitution und verwandte Phänomene
Joel Rosenthal und David I., Schuster
Journal of Chemical Education 2003, 80 (6), 679
DOI: 1021/ed080p679
Ein sehr Interessantes Papier, geeignet für neugierige Studenten, und beschreibt etwas, das die meisten Praktizierenden organischer Chemiker wissen empirisch – fluorbenzol ist fast so, als reaktiver als Benzol in EAS oder Friedel-Crafts-Reaktionen, das ist widersinnig, wenn man bedenkt, elektronische Effekte! - Organic chemistry
N. Haworth, C. K. Ingold, T. A. Henry
Ann. Rep. Prog. Chem. 1926, 23, 74-185
DOI: 10.1039/AR9262300074
Ein frühes Papier diskutieren Regie Effekte in EAS. Pp., 136 und 137 enthalten Zahlen, die den Elektronenfluss darstellen. Pg. 140 diskutiert die Meta-Richtung, die aus den „entgegengesetzten“ Gründen als o/p-Richtung durch Alkylgruppen auftritt.