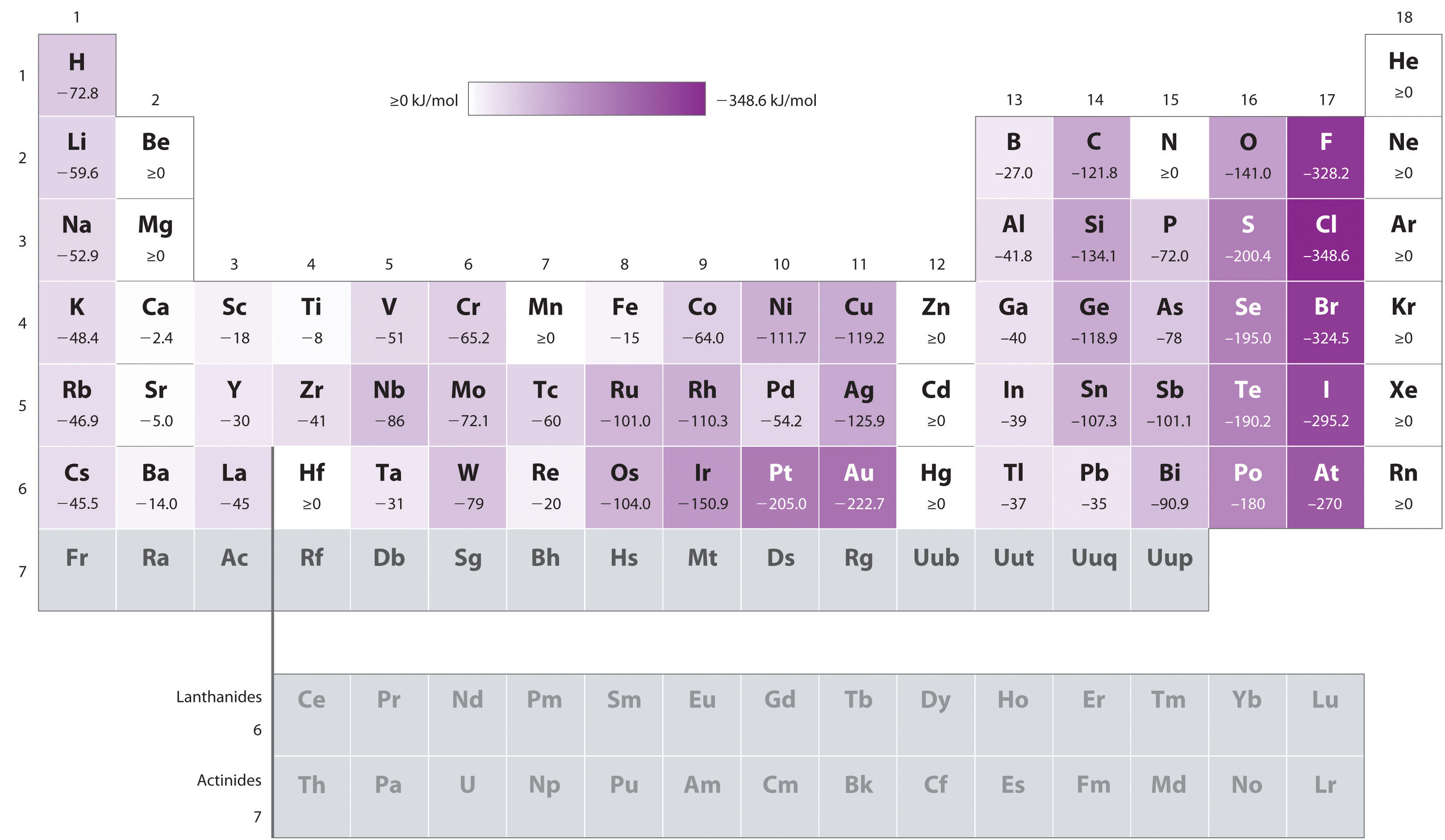
Atomy o największych promieniach, które mają najniższe Energie jonizacji( powinowactwo do własnych elektronów walencyjnych), również mają najniższe powinowactwo do dodanego elektronu. Istnieją jednak dwa główne wyjątki od tego trendu:
- powinowactwa elektronowe pierwiastków B do F w drugim rzędzie układu okresowego są mniej ujemne niż pierwiastków znajdujących się bezpośrednio pod nimi w trzecim rzędzie., Najwyraźniej zwiększone odpychanie elektronów-elektronów doświadczane przez elektrony ograniczone do stosunkowo małych orbitali 2p pokonuje zwiększone przyciąganie elektron-jądro w krótkich odległościach jądrowych. Fluor ma zatem mniejsze powinowactwo do dodanego elektronu niż chlor. W konsekwencji pierwiastki trzeciego rzędu (n = 3) mają najwięcej ujemnych powinowactw elektronowych. Dalej w dół kolumny, przyciąganie dodanego elektronu maleje, ponieważ elektron wchodzi w orbital bardziej odległy od jądra., Elektron-odpychanie elektronów również zmniejsza się, ponieważ elektrony walencyjne zajmują większą objętość przestrzeni. Efekty te mają tendencję do anulowania się nawzajem, więc zmiany powinowactwa elektronów w rodzinie są znacznie mniejsze niż zmiany energii jonizacji.
- powinowactwa elektronowe metali ziem alkalicznych stają się bardziej ujemne z Be Do Ba. Separacja energii pomiędzy wypełnionymi NS2 i pustymi podshellami np maleje wraz ze wzrostem N, tak że tworzenie anionu z cięższych pierwiastków staje się bardziej korzystne energetycznie.,
równania dla drugiej i wyższej energii jonizacji są analogiczne do tych dla drugiej i wyższej energii jonizacji:
\
jak widzieliśmy, pierwsze powinowactwo elektronów może być większe lub równe zero lub ujemne, w zależności od konfiguracji elektronowej atomu. Natomiast powinowactwo drugiego elektronu jest zawsze dodatnie, ponieważ zwiększone odpychanie elektronów w dianionie jest znacznie większe niż przyciąganie jądra dla dodatkowych elektronów., Na przykład, pierwsze powinowactwo elektronowe tlenu wynosi -141 kJ/mol, ale drugie powinowactwo elektronowe wynosi +744 kJ/mol:
\
\
zatem tworzenie się tlenku gazowego (\(O^{2−}\)) jonu jest energetycznie dość niekorzystne (oszacowane przez dodanie obu etapów):
\
podczas gdy powinowactwa pierwszych elektronów mogą być ujemne, dodatnie lub zerowe, powinowactwa drugich elektronów są zawsze dodatnie.,
Jeśli energia jest potrzebna do utworzenia zarówno dodatnio naładowanych kationów, jak i monatomowych polianionów, dlaczego związki jonowe, takie jak \(MgO\), \(Na_2s\) i \(na_3p\), tworzą się w ogóle? Kluczowym czynnikiem w tworzeniu stabilnych związków jonowych są korzystne oddziaływania elektrostatyczne między kationami a anionami w soli krystalicznej.
przykład \(\PageIndex{1}\): kontrastujące powinowactwa elektronowe Sb, Se i Te
na podstawie ich pozycji w układzie okresowym, które z Sb, Se lub Te miałyby najbardziej ujemne powinowactwo elektronowe?,
Podane: trzy pierwiastki
poproszony o: pierwiastek o najbardziej ujemnym powinowactwie elektronowym
strategia:
- Zlokalizuj pierwiastki w układzie okresowym. Użyj trendów w powinowactwach elektronów idących w dół kolumny dla pierwiastków w tej samej grupie. Podobnie, użyj trendów powinowactwa elektronów od lewej do prawej dla elementów w tym samym rzędzie.
- umieść pierwiastki w kolejności, wymieniając pierwiastek o najbardziej ujemnym powinowactwie elektronowym.,
rozwiązanie:
A wiemy, że powinowactwa elektronowe stają się mniej ujemne idąc w dół kolumny (z wyjątkiem anomalnie niskich powinowactw elektronowych elementów drugiego rzędu), więc możemy przewidzieć, że powinowactwo elektronowe Se jest bardziej ujemne niż powinowactwo Te. Wiemy również, że powinowactwa elektronów stają się bardziej ujemne od lewej do prawej w całym rzędzie i że pierwiastki grupy 15 mają zwykle wartości mniej ujemne niż oczekiwano., Ponieważ SB Znajduje się po lewej stronie Te i należy do grupy 15, przewidujemy, że powinowactwo elektronowe Te jest bardziej ujemne niż powinowactwo Sb. Całkowita kolejność to Se < Te < Sb, więc Se ma najbardziej ujemne powinowactwo elektronów spośród trzech pierwiastków.