cele uczenia się
- Porównaj mutacje punktowe i mutacje zmiennoprzecinkowe
- opisz różnice między mutacjami missense, nonsensowymi i silent
- opisz różnice między naprawą światła i ciemności
- wyjaśnij, jak działają różne mutageny
- wyjaśnij, dlaczego test Amesa może być użyty do wykrywania czynników rakotwórczych
- Analizuj sekwencje DNA i identyfikuj przykłady z rodzajów mutacji
mutacja jest dziedziczną zmianą w sekwencji DNA organizmu., Powstały organizm, zwany mutantem, może mieć rozpoznawalną zmianę fenotypu w porównaniu z typem dzikim, który jest fenotypem najczęściej obserwowanym w przyrodzie. Zmiana w sekwencji DNA jest nadawana mRNA poprzez transkrypcję i może prowadzić do zmiany sekwencji aminokwasów w białku podczas translacji. Ponieważ białka pełnią większość funkcji komórkowych, zmiana sekwencji aminokwasów w białku może prowadzić do zmiany fenotypu komórki i organizmu.,
wpływ mutacji na sekwencję DNA
istnieje kilka rodzajów mutacji, które są klasyfikowane według sposobu zmiany cząsteczki DNA. Jeden typ, zwany mutacją punktową, wpływa na pojedynczą bazę i najczęściej występuje, gdy jedna baza jest podstawiona lub zastąpiona przez inną. Mutacje wynikają również z dodania jednej lub więcej baz, znanych jako wstawienie, lub usunięcia jednej lub więcej baz, znanych jako delecja.
pomyśl o tym
- jaki rodzaj mutacji występuje, gdy gen ma dwa mniej nukleotydów w sekwencji?,
wpływ mutacji na strukturę i funkcję białka
mutacje punktowe mogą mieć szeroki zakres wpływu na funkcję białka (ryc. 1). W konsekwencji degeneracji kodu genetycznego, mutacja punktowa spowoduje, że ten sam aminokwas zostanie włączony do powstałego polipeptydu pomimo zmiany sekwencji. Zmiana ta nie miałaby wpływu na strukturę białka i dlatego jest nazywana cichą mutacją. Mutacja missense powoduje włączenie innego aminokwasu do powstałego polipeptydu., Efekt mutacji missense zależy od tego, jak chemicznie różni się nowy aminokwas od aminokwasu dzikiego. Ważne jest również umiejscowienie zmienionego aminokwasu w białku. Na przykład, jeśli zmieniony aminokwas jest częścią aktywnego miejsca enzymu, efekt mutacji missense może być znaczący. Wiele mutacji missense powoduje powstawanie białek, które są nadal funkcjonalne, przynajmniej do pewnego stopnia. Czasami skutki mutacji missense mogą być widoczne tylko w pewnych warunkach środowiskowych; takie mutacje missense nazywane są mutacjami warunkowymi., Rzadko, mutacja missense może być korzystna. W odpowiednich warunkach środowiskowych ten rodzaj mutacji może dać organizmowi, który go ukrywa, selektywną przewagę. Jeszcze inny typ mutacji punktowej, zwany mutacją nonsensowną, przekształca kodon kodujący aminokwas (kodon zmysłowy) w kodon stopowy (kodon nonsensowny). Mutacje nonsensowne powodują syntezę białek, które są krótsze od typu dzikiego i zazwyczaj nie funkcjonują.
delecje i wstawki powodują również różne efekty., Ponieważ kodony są trojaczkami nukleotydów, insercje lub delecje w grupach trzech nukleotydów mogą prowadzić do wstawienia lub delecji jednego lub więcej aminokwasów i mogą nie powodować znaczącego wpływu na funkcjonalność powstałego białka. Jednak mutacje związane z przesunięciem ramki, spowodowane przez wstawienie lub delecje wielu nukleotydów, które nie są wielokrotnością trzech, są niezwykle problematyczne, ponieważ zmiana w wyniku odczytu ramki (Rysunek 1). Ponieważ rybosomy odczytują mRNA w kodonach trypletu, mutacje frameshift mogą zmieniać każdy aminokwas po punkcie mutacji., Nowa ramka odczytu może również zawierać kodon stop przed końcem sekwencji kodowania. W związku z tym białka wytworzone z genów zawierających mutacje frameshift są prawie zawsze niefunkcjonalne.
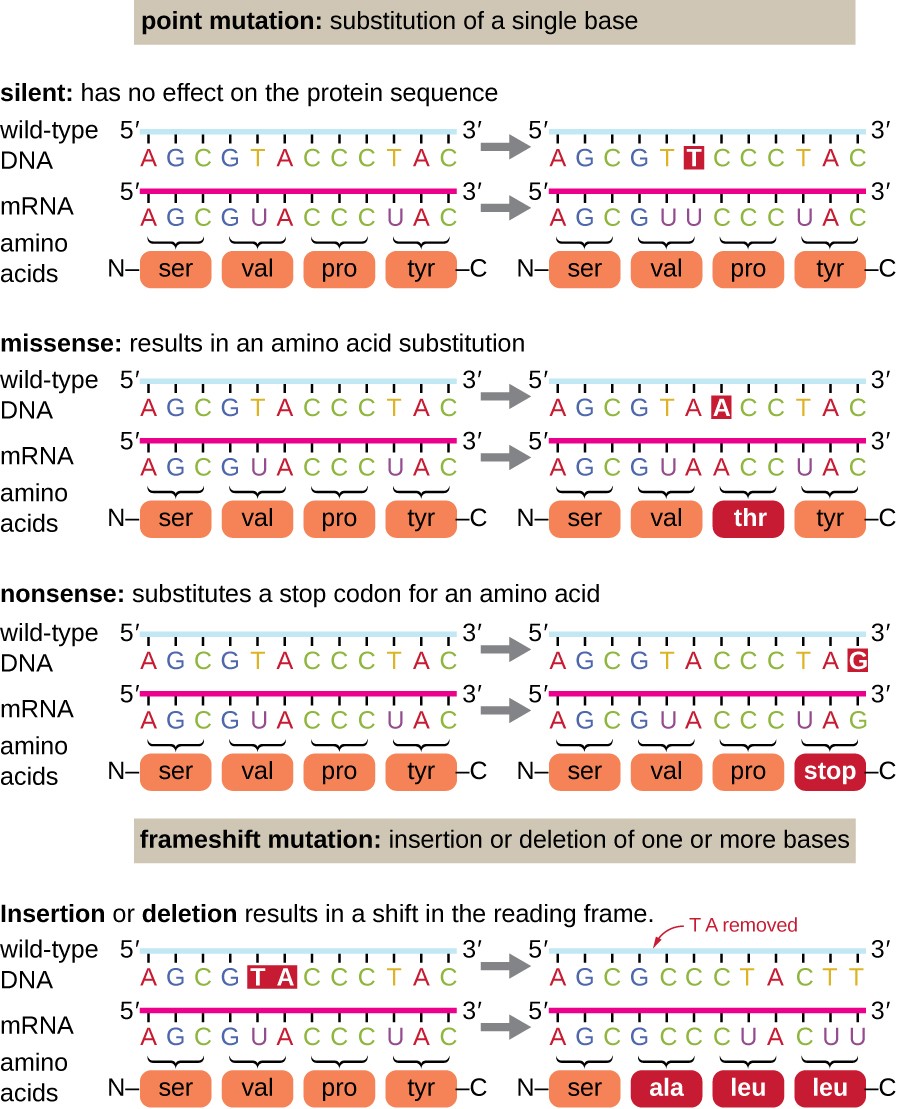
Rysunek 1. Kliknij, aby powiększyć obraz. Mutacje mogą prowadzić do zmian w sekwencji białek kodowanych przez DNA.
pomyśl o tym
- jakie są powody, dla których zmiana nukleotydu w genie na białko może nie mieć żadnego wpływu na fenotyp tego genu?,
- czy możliwe jest umieszczenie trzech nukleotydów razem po piątym nukleotydzie w genie kodującym białko w celu wytworzenia białka krótszego niż normalnie? Jak czy nie?
korzystna mutacja
od czasu pierwszego przypadku zakażenia ludzkim wirusem niedoboru odporności (HIV) odnotowano w 1981 roku, prawie 40 milionów ludzi zmarło z powodu zakażenia HIV, wirusa, który powoduje zespół nabytego niedoboru odporności (AIDS)., Wirus atakuje pomocnicze komórki T, które odgrywają kluczową rolę w mostkowaniu wrodzonej i adaptacyjnej odpowiedzi immunologicznej, infekując i zabijając komórki normalnie zaangażowane w odpowiedź organizmu na infekcję. Nie ma lekarstwa na zakażenie wirusem HIV, ale wiele leków zostało opracowanych w celu spowolnienia lub zablokowania progresji wirusa. Chociaż osoby na całym świecie mogą być zakażone, najwięcej zachorowań wśród osób w wieku 15-49 lat występuje w Afryce Subsaharyjskiej, gdzie prawie jedna osoba na 20 jest zakażona, co stanowi ponad 70% zakażeń na całym świecie (wykres 2)., Niestety, jest to również część świata, gdzie strategie zapobiegania i leki w leczeniu infekcji są najbardziej brakuje.

Rysunek 2. HIV jest bardzo rozpowszechniony w Afryce Subsaharyjskiej, ale jego częstość występowania jest dość niska w niektórych innych częściach świata.
w ostatnich latach zainteresowanie naukowe wzbudziło odkrycie kilku osobników z Północnej Europy, które są odporne na zakażenie HIV. W 1998 roku amerykański genetyk Stephen J., O ' Brien z National Institutes of Health (NIH) i współpracownicy opublikowali wyniki swojej analizy genetycznej ponad 4000 osobników. Wskazują one, że wiele osobników pochodzenia eurazjatyckiego (do 14% w niektórych grupach etnicznych) ma mutację delecji, zwaną CCR5-delta 32, w genie kodującym CCR5. CCR5 jest coreceptor znajduje się na powierzchni limfocytów T, który jest niezbędny dla wielu szczepów wirusa, aby dostać się do komórki gospodarza. Mutacja prowadzi do produkcji receptora, do którego HIV nie może skutecznie wiązać i tym samym blokuje wejście wirusa., Osoby homozygotyczne dla tej mutacji mają znacznie zmniejszoną podatność na zakażenie HIV, a ci, którzy są heterozygotyczni mają pewną ochronę przed zakażeniem, jak również.
nie jest jasne, dlaczego ludzie pochodzenia północnoeuropejskiego, konkretnie, nosi tę mutację, ale jej częstość wydaje się być najwyższa w Europie Północnej i stale zmniejsza się w populacjach, gdy jeden porusza się na południe. Badania wskazują, że mutacja była obecna jeszcze przed pojawieniem się wirusa HIV i mogła zostać wybrana w populacjach europejskich w wyniku narażenia na dżumę lub ospę., Mutacja ta może chronić osoby przed dżumą (wywołaną przez bakterię Yersinia pestis) i ospą (wywołaną przez wirus variola), ponieważ ten receptor może być również zaangażowany w te choroby. Wiek tej mutacji jest kwestią dyskusyjną, ale szacunki sugerują, że pojawiła się między 1875 a 225 lat temu i mogła zostać rozprzestrzeniona z Północnej Europy przez najazdy Wikingów.
to ekscytujące odkrycie doprowadziło do nowych możliwości w badaniach nad HIV, w tym poszukiwania leków blokujących Wiązanie CCR5 z HIV u osób, które nie mają mutacji., Chociaż badanie DNA w celu określenia, które osoby posiadają mutację CCR5-delta 32 jest możliwe, istnieją udokumentowane przypadki osób homozygotycznych dla mutacji zarażających HIV. Z tego powodu badania DNA w kierunku mutacji nie są powszechnie zalecane przez urzędników służby zdrowia publicznego, aby nie zachęcać do ryzykownych zachowań u tych, którzy noszą mutację. Niemniej jednak hamowanie wiązania HIV z CCR5 nadal jest ważną strategią rozwoju terapii lekowych dla osób zakażonych wirusem HIV.,
przyczyny mutacji
błędy w procesie replikacji DNA mogą powodować spontaniczne mutacje. Poziom błędu polimerazy DNA wynosi jedną nieprawidłową zasadę na miliard replikowanych par zasad. Ekspozycja na mutageny może powodować indukowane mutacje, które są różnego rodzaju czynnikami chemicznymi lub promieniowaniem (Tabela 1). Ekspozycja na mutagen może zwiększyć szybkość mutacji ponad 1000-krotnie. Mutageny są często również rakotwórcze, czynniki, które powodują raka. Jednakże, podczas gdy prawie wszystkie czynniki rakotwórcze są mutagenne, nie wszystkie mutageny są koniecznie rakotwórcze.,
| Tabela 1., to AT base pair | Point | |||
|---|---|---|---|---|
| Intercalating agents | ||||
| Acridine orange, ethidium bromide, polycyclic aromatic hydrocarbons | Distorts double helix, creates unusual spacing between nucleotides | Introduces small deletions and insertions | Frameshift | |
| Ionizing radiation | ||||
| X-rays, γ-rays | Forms hydroxyl radicals | Causes single- and double-strand DNA breaks | Repair mechanisms may introduce mutations | |
| X-rays, γ-rays | Modifies bases (e.,g., deaminacja C do U) | konwertuje GC do pary bazowej | Punkt | |
| promieniowanie Niejonujące | ||||
| ultrafiolet | tworzy dimery pirymidyny (Zwykle tyminy) | powoduje błędy replikacji DNA | lub punkt | |
mutageny chemiczne
różne rodzaje mutagenów chemicznych oddziałują bezpośrednio z dna, działając jako analogi nukleozydów lub modyfikując Zasady nukleotydów., Substancje chemiczne zwane analogami nukleozydów są strukturalnie podobne do normalnych zasad nukleotydowych i mogą być włączone do DNA podczas replikacji (ryc. 3). Te analogi baz wywołują mutacje, ponieważ często mają inne zasady parowania baz niż bazy, które zastępują. Inne mutageny chemiczne mogą modyfikować normalne zasady DNA, co powoduje różne zasady parowania zasad. Na przykład kwas azotowy deaminuje cytozynę, przekształcając ją w uracyl. Uracyl następnie paruje z adeniną w kolejnej rundzie replikacji, powodując konwersję pary zasadowej GC do pary zasadowej AT., Kwas azotowy deaminuje również adeninę do hipoksantyny, która para zasad z cytozyną zamiast tyminy, powodując konwersję pary zasad TA do pary zasad CG.

Rysunek 3. Kliknij, aby powiększyć obraz. a) nukleozyd 2-aminopuryny (2AP) strukturalnie jest analogiem nukleozydu do nukleozydu adeniny, podczas gdy 5-bromouracyl (5BU) jest analogiem nukleozydu do nukleozydu tyminy. Para bazowa 2AP z C, przekształcająca parę bazową AT w parę bazową GC po kilku rundach replikacji., 5BU par z G, przekształcając parę bazową AT w parę bazową GC po kilku rundach replikacji. (b) kwas azotowy jest innym rodzajem mutagenu chemicznego, który modyfikuje już istniejące zasady nukleozydowe, takie jak C, aby wytworzyć U, które pary zasad z A. ta modyfikacja chemiczna, jak pokazano tutaj, powoduje przekształcenie pary zasad CG do pary zasad TA.
mutageny chemiczne zwane czynnikami interkalującymi działają inaczej., Cząsteczki te przesuwają się między ułożonymi zasadami azotowymi podwójnej helisy DNA, zniekształcając cząsteczkę i tworząc nietypowe odstępy między parami zasad nukleotydowych (ryc. 4). W rezultacie, podczas replikacji DNA, polimeraza DNA może albo pominąć replikację kilku nukleotydów (tworząc delecję) lub wstawić dodatkowe nukleotydy (tworząc insercję). Oba wyniki mogą prowadzić do mutacji frameshift. Produkty spalania, takie jak wielopierścieniowe węglowodory aromatyczne, są szczególnie niebezpiecznymi czynnikami interkalującymi, które mogą prowadzić do nowotworów spowodowanych mutacjami., Środki interkalujące bromek etydydy i pomarańcza akrydyny są powszechnie stosowane w laboratorium do plam DNA do wizualizacji i są potencjalnymi mutagenami.

Rysunek 4. Czynniki interkalujące, takie jak akrydyna, wprowadzają nietypowe odstępy między parami zasad, w wyniku czego polimeraza DNA wprowadza delecję lub insercję, co prowadzi do potencjalnej mutacji zmiany struktury.
promieniowanie
narażenie na promieniowanie jonizujące lub niejonujące może wywoływać mutacje w DNA, chociaż przez różne mechanizmy., Silne promieniowanie jonizujące, takie jak promieniowanie rentgenowskie i gamma, może powodować jedno – i dwuniciowe przerwy w kręgosłupie DNA poprzez tworzenie rodników hydroksylowych przy ekspozycji na promieniowanie (ryc. 5). Promieniowanie jonizujące może również modyfikować zasady; na przykład deaminacja cytozyny do uracylu, analogiczna do działania kwasu azotowego. Ekspozycja na promieniowanie jonizujące jest używana do zabijania drobnoustrojów w celu sterylizacji urządzeń medycznych i żywności, ze względu na jego dramatyczny niespecyficzny wpływ na uszkodzenie DNA, białek i innych składników komórkowych (patrz Używanie metod fizycznych do kontroli mikroorganizmów).,
promieniowanie niejonowe, podobnie jak światło ultrafioletowe, nie jest wystarczająco energiczne, aby zainicjować tego typu zmiany chemiczne. Jednak promieniowanie nonionizujące może indukować tworzenie dimerów między dwoma sąsiadującymi zasadami pirymidynowymi, Zwykle dwoma tymiminami, w obrębie nici nukleotydowej. Podczas tworzenia dimeru tyminy dwie sąsiadujące tyminy łączą się kowalencyjnie i, jeśli pozostaną nienaparowane, zarówno replikacja DNA, jak i transkrypcja zostają wstrzymane w tym momencie. Polimeraza DNA może kontynuować i replikować dimer nieprawidłowo, potencjalnie prowadząc do frameshift lub mutacje punktowe.,

Rysunek 5. (a) promieniowanie jonizujące może prowadzić do tworzenia jednoniciowych i dwuniciowych przerw w szkielecie cukrowo-fosforanowym DNA, jak również do modyfikacji zasad(nie pokazano). (b) promieniowanie Nonionizujące, takie jak światło ultrafioletowe, może prowadzić do powstawania dimerów tyminowych, które mogą opóźnić replikację i transkrypcję oraz wprowadzić zmiany w ramkach lub mutacje punktowe.
pomyśl o tym
- jak bazowy analog wprowadza mutację?,
- w jaki sposób czynnik interkalujący wprowadza mutację?
- jaki rodzaj mutagenu powoduje dimery tyminy?
Naprawa DNA
proces replikacji DNA jest bardzo dokładny, ale błędy mogą wystąpić spontanicznie lub być indukowane przez mutageny. Nieskorygowane błędy mogą prowadzić do poważnych konsekwencji dla fenotypu. Komórki rozwinęły kilka mechanizmów naprawczych, aby zminimalizować liczbę mutacji, które utrzymują się.,
korekta
większość błędów wprowadzonych podczas replikacji DNA jest natychmiast korygowana przez większość polimeraz DNA za pomocą funkcji zwanej korektą. Podczas korekty polimeraza DNA odczytuje nowo dodaną zasadę, upewniając się, że jest ona komplementarna do odpowiadającej jej zasady w nici szablonu przed dodaniem kolejnej. Jeśli dodano nieprawidłową zasadę, enzym wykonuje cięcie, aby uwolnić niewłaściwy nukleotyd i dodaje się nową zasadę.,
Naprawa niedopasowania
niektóre błędy wprowadzone podczas replikacji są korygowane krótko po przeniesieniu maszyny replikacyjnej. Mechanizm ten nazywa się naprawą niedopasowania. Enzymy biorące udział w tym mechanizmie rozpoznają nieprawidłowo dodany nukleotyd, usuwają go i zastępują prawidłową zasadą. Jednym z przykładów jest naprawa niedopasowania ukierunkowanego na metyl w E. coli. DNA jest hemimetylowane. Oznacza to, że nić rodzicielska jest metylowana, podczas gdy nowo zsyntetyzowana nić córka nie jest. Trwa kilka minut, zanim nowa nić zostanie metylowana., Białka MutS, MutL i MutH wiążą się z hemimetylowanym miejscem, w którym znajduje się nieprawidłowy nukleotyd. MutH przecina niemetylowaną nić (nową nić). Egzonukleaza usuwa część nici (w tym nieprawidłowy nukleotyd). Utworzona luka jest następnie wypełniana przez DNA pol III i ligazę.
Naprawa dimerów Tyminowych
ponieważ produkcja dimerów tyminowych jest powszechna (wiele organizmów nie może uniknąć światła ultrafioletowego), rozwinęły się mechanizmy naprawy tych zmian., W naprawie wycięć nukleotydów (zwanej również naprawą ciemną) enzymy usuwają dimer pirymidynowy i zastępują go prawidłowymi nukleotydami (ryc. 6). W E. coli DNA jest skanowane przez kompleks enzymatyczny. Jeśli okaże się zniekształcenie podwójnej helisy, które zostało wprowadzone przez dimer pirymidynowy, kompleks enzymatyczny przecina szkielet cukrowo-fosforanowy kilka zasad przed i za dimerem, a segment DNA między tymi dwoma cięciami jest następnie usuwany enzymatycznie. DNA pol I zastępuje brakujące nukleotydy poprawnymi, a ligaza DNA uszczelnia lukę w kręgosłupie cukrowo-fosforanowym.,
bezpośrednia naprawa (zwana również naprawą światła) dimerów tyminowych następuje w procesie fotoreaktywacji w obecności światła widzialnego. Enzym zwany fotoliazą rozpoznaje zniekształcenia w helisie DNA spowodowane przez dimer tyminy i wiąże się z dimerem. Następnie, w obecności światła widzialnego, enzym fotoliazy zmienia konformację i rozdziera dimer tyminy, pozwalając tyminom ponownie prawidłowo połączyć się z adeninami na komplementarnej nici., Fotoreaktywacja wydaje się być obecna we wszystkich organizmach, z wyjątkiem ssaków łożyskowych, w tym ludzi. Fotoreaktywacja jest szczególnie ważna dla organizmów chronicznie narażonych na promieniowanie ultrafioletowe, takich jak rośliny, bakterie fotosyntetyczne, glony i korale, aby zapobiec gromadzeniu się mutacji spowodowanych przez tworzenie dimerów tyminy.

Rysunek 6. Kliknij, aby powiększyć obraz. Bakterie mają dwa mechanizmy naprawy dimerów tyminy., (a) w naprawie wycięć nukleotydów kompleks enzymatyczny rozpoznaje zniekształcenia w kompleksie DNA wokół dimeru tyminy oraz wycina i usuwa uszkodzone pasmo DNA. Prawidłowe nukleotydy są zastępowane przez DNA pol I, a nić nukleotydowa jest uszczelniona przez ligazę DNA. b) w procesie fotoreaktywacji enzym fotoliaza wiąże się z dimerem tyminy i w obecności światła widzialnego rozkłada dimer, przywracając parowanie bazowe tyminy z adeninami uzupełniającymi na przeciwległej nici DNA.,
zastanów się nad tym
- podczas naprawy niedopasowania, jak enzym rozpoznaje, który jest nowy, a który Stary?
- w jaki sposób czynnik interkalujący wprowadza mutację?
- jaki rodzaj mutacji naprawia fotoliaza?
Identyfikacja mutantów bakteryjnych
jedną z powszechnych technik identyfikacji mutantów bakteryjnych jest replikowanie., Technika ta jest używana do wykrywania mutantów odżywczych, zwanych auksotropami, które mają mutację w genie kodującym enzym w szlaku biosyntezy określonego składnika odżywczego, takiego jak aminokwas. W rezultacie, podczas gdy komórki typu dzikiego zachowują zdolność do normalnego wzrostu na podłożu pozbawionym określonego składnika odżywczego, auksotropy nie są w stanie rosnąć na takim podłożu. Podczas replikacji (ryc. 7) populacja komórek bakteryjnych jest mutagenizowana, a następnie platerowana jako pojedyncze komórki na złożonej, pełnowartościowej płytce i pozwala wyrosnąć w Kolonie., Komórki z tych kolonii są usuwane z tej płyty głównej, często za pomocą sterylnego aksamitu. Ten aksamit, zawierający komórki, jest następnie prasowany w tej samej orientacji na płyty różnych mediów. Co najmniej jedna płytka powinna być również kompletna pod względem odżywczym, aby zapewnić prawidłowe przenoszenie komórek między płytkami. W innych płytkach brakuje określonych składników odżywczych, co pozwala badaczowi odkryć różne mutanty auksotropowe niezdolne do produkcji określonych składników odżywczych. Komórki z odpowiedniej kolonii na pożywnie kompletnej płytce mogą być wykorzystane do odzyskania mutanta do dalszych badań.,

Rysunek 7. Identyfikacja auxotrophic mutants, podobnie jak histydyna auxotrophs, dokonuje się przy użyciu replicating. Po mutagenezie kolonie, które rosną na pożywce pełnej, ale nie na pożywce pozbawionej histydyny, są identyfikowane jako auksotropy histydyny.
zastanów się nad tym
- dlaczego komórki są platerowane na pełnowartościowej płytce oprócz płytek z niedoborem składników odżywczych, gdy szukasz mutanta?,
Test Amesa
test Amesa, opracowany przez Bruce ' a Amesa (1928–) w latach 70., jest metodą wykorzystującą bakterie do szybkiego, niedrogiego badania rakotwórczego potencjału nowych związków chemicznych. Test mierzy szybkość mutacji związaną z ekspozycją na związek, co, jeśli jest podwyższone, może wskazywać, że ekspozycja na ten związek jest związana z większym ryzykiem raka., Test Amesa wykorzystuje jako organizm badany szczep Salmonella typhimurium, który jest auksotropem histydyny, niezdolnym do syntezy własnej histydyny z powodu mutacji w genie niezbędnym do jej syntezy. Po ekspozycji na potencjalny mutagen bakterie te są platerowane na pożywce pozbawionej histydyny, a liczba mutantów odzyskujących zdolność syntezy histydyny jest rejestrowana i porównywana z liczbą takich mutantów, które powstają w przypadku braku potencjalnego mutagenu (ryc. 8)., Chemikalia, które są bardziej mutagenne, przyniosą więcej mutantów z przywróconą syntezą histydyny w teście Amesa. Ponieważ wiele substancji chemicznych nie jest bezpośrednio mutagennych, ale są metabolizowane do postaci mutagennych przez enzymy wątrobowe, ekstrakt z wątroby szczura jest powszechnie zawarty na początku tego eksperymentu w celu naśladowania metabolizmu wątroby. Po przeprowadzeniu testu Amesa związki zidentyfikowane jako mutagenne są dalej badane pod kątem ich potencjalnych właściwości rakotwórczych za pomocą innych modeli, w tym modeli zwierzęcych, takich jak myszy i szczury.
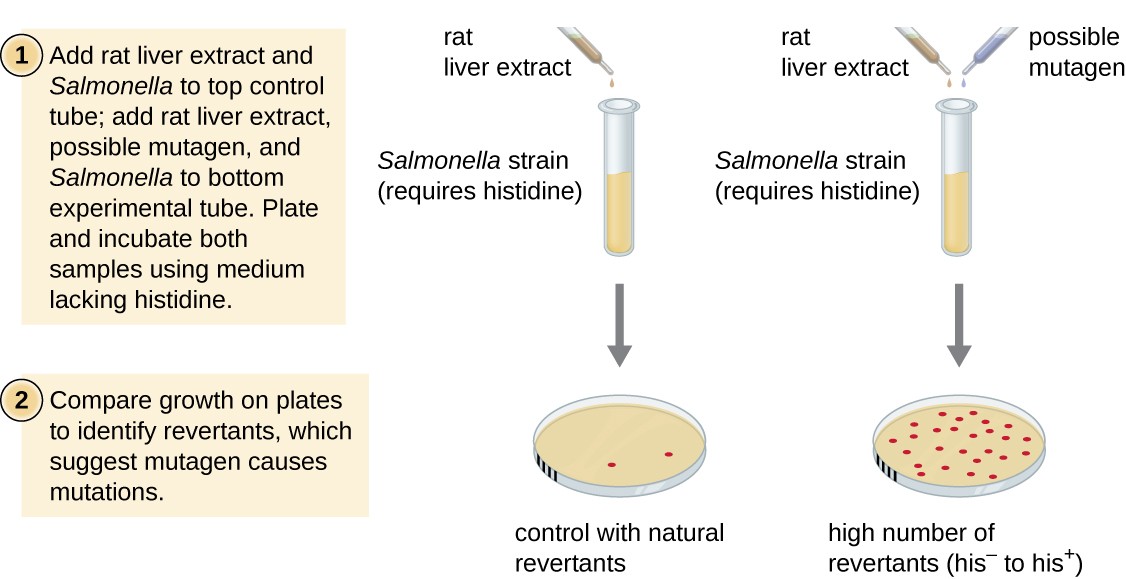
Rysunek 8., Test Amesa służy do identyfikacji mutagennych, potencjalnie rakotwórczych substancji chemicznych. Jako szczep testowy stosuje się auksotroph histydyny Salmonella, narażony na działanie potencjalnego mutagenu/rakotwórczego. Liczba mutantów odwracalnych zdolnych do wzrostu w przypadku braku dostarczonej histydyny jest liczona i porównywana z liczbą naturalnych mutantów odwracalnych, które powstają w przypadku braku potencjalnego mutagenu.
pomyśl o tym
- jaka mutacja jest stosowana jako wskaźnik częstości mutacji w teście Amesa?
- dlaczego test Amesa może działać jako test na rakotwórczość?,
kluczowe pojęcia i podsumowanie
- mutacja jest dziedziczną zmianą w DNA. Mutacja może prowadzić do zmiany sekwencji aminokwasów białka, prawdopodobnie wpływając na jego funkcję.
- mutacja punktowa dotyczy jednej pary bazowej. Mutacja punktowa może spowodować mutację cichą, jeśli kodon mRNA koduje ten sam aminokwas, mutację missense, jeśli kodon mRNA koduje inny aminokwas, lub mutację nonsensowną, jeśli kodon mRNA staje się kodonem stop.,
- mutacje Missense mogą zachować funkcję, w zależności od chemii nowego aminokwasu i jego lokalizacji w białku. Nonsensowne mutacje wytwarzają okrojone i często niefunkcjonalne białka.
- mutacja frameshift wynika z wstawiania lub delecji liczby nukleotydów, która nie jest wielokrotnością trzech. Zmiana ramki odczytu zmienia każdy aminokwas po punkcie mutacji i skutkuje niefunkcjonalnym białkiem.
- mutacje spontaniczne występują w wyniku błędów replikacji DNA, podczas gdy mutacje indukowane występują w wyniku ekspozycji na mutagen.,
- czynniki mutagenne są często rakotwórcze, ale nie zawsze. Jednak prawie wszystkie czynniki rakotwórcze są mutagenne.
- mutageny chemiczne obejmują analogi zasad i substancje chemiczne, które modyfikują istniejące zasady. W obu przypadkach mutacje są wprowadzane po kilku rundach replikacji DNA.
- promieniowanie jonizujące, takie jak promienie rentgenowskie i promienie γ, prowadzi do złamania szkieletu fosfodiestrowego DNA i może również chemicznie modyfikować zasady, aby zmienić ich zasady parowania zasad.,
- promieniowanie Nonionizujące, takie jak światło ultrafioletowe, może wprowadzać dimery pirymidynowe (tyminowe), które podczas replikacji i transkrypcji DNA mogą powodować mutacje frameshift lub punktowe.
- komórki mają mechanizmy naprawy naturalnie występujących mutacji. Polimeraza DNA wykazuje aktywność korekcyjną. Naprawa niedopasowania (ang. Mismatch repair) – proces naprawy nieprawidłowo wbudowanych baz po zakończeniu replikacji DNA.
- dimery pirymidynowe można również naprawić., W naprawie wycięć nukleotydów (dark repair) enzymy rozpoznają zniekształcenia wprowadzone przez dimer pirymidynowy i zastępują uszkodzone nici prawidłowymi zasadami, wykorzystując nieuszkodzoną nić DNA jako szablon. Bakterie i inne organizmy mogą również stosować naprawę bezpośrednią, w której enzym fotoliazy, w obecności światła widzialnego, rozkłada pirymidyny.
- poprzez porównanie wzrostu na całej płytce i braku wzrostu na nośnikach pozbawionych określonych składników odżywczych, można zidentyfikować specyficzne mutanty utraty funkcji zwane auksotropami.,
- test Amesa jest niedrogą metodą, która wykorzystuje bakterie auksotropowe do pomiaru mutagenności związku chemicznego. Mutagenność jest wskaźnikiem potencjalnego działania rakotwórczego.
wielokrotnego wyboru
która z poniższych zmian jest zmianą sekwencji, która prowadzi do powstania kodonu stop?
- mutacja missense
- mutacja nonsensowna
- mutacja cicha
- mutacja delecji
powstawanie dimerów pirymidynowych wynika z którego z poniższych wyników?
- spontaniczne błędy polimerazy DNA
- ekspozycja na promieniowanie gamma
- ekspozycja na promieniowanie ultrafioletowe
- ekspozycja na środki interkalujące
który z poniższych przykładów jest przykładem mutacji frameshift?
- a usunięcie kodu
- mutacja missense
- mutacja cicha
- usunięcie jednego nukleotydu
który z poniższych rodzajów naprawy DNA, w którym dimery tyminy są bezpośrednio rozkładane przez fotoliazę enzymu?,
- bezpośrednia naprawa
- naprawa wycięcia nukleotydów
- naprawa niedopasowania
- korekta
która z poniższych kwestii dotyczących testu Amesa jest prawdziwa?
- służy do identyfikacji nowo powstałych mutantów auksotropowych.
- służy do identyfikacji mutantów o przywróconej aktywności biosyntetycznej.
- służy do identyfikacji spontanicznych mutantów.,
- służy do identyfikacji mutantów pozbawionych aktywności fotoreaktywnej.
wypełnij puste pole
mutagen chemiczny, który jest strukturalnie podobny do nukleotydu, ale ma różne zasady parowania zasad nazywa się_________.,
enzym stosowany w naprawie światła do podziału dimerów tyminy nazywa się________.
fenotyp organizmu, który jest najczęściej obserwowany w przyrodzie, nazywa się ________.,
True/False
substancje rakotwórcze są zazwyczaj mutagenne.
pomyśl o tym
Dlaczego jest bardziej prawdopodobne, że wstawienie lub usunięcie będzie bardziej szkodliwe dla komórki niż mutacje punktowe?,
Dlaczego uważasz, że test Amesa jest korzystniejszy niż wykorzystanie modeli zwierzęcych do badania związków chemicznych pod kątem mutagenności?
krytyczne myślenie
Poniżej znajduje się kilka sekwencji DNA, które są zmutowane w porównaniu z sekwencją typu dzikiego: 3′-T A C T G A C T G A C G A T C-5′. Wyobraź sobie, że każda z nich jest sekcją cząsteczki DNA, która została oddzielona w przygotowaniu do transkrypcji, więc widzisz tylko pasemko szablonu., Konstruuj komplementarne sekwencje DNA (wskazujące końce 5′ I 3′) dla każdej zmutowanej sekwencji DNA, następnie transkrybuj (wskazujące końce 5′ I 3′) nici szablonu i przetłumacz cząsteczki mRNA za pomocą kodu genetycznego, rejestrując otrzymaną sekwencję aminokwasów(wskazującą końce N I C). Co to za mutacja?,
uzupełniająca sekwencja DNA:
Sekwencja mRNA transkrybowana z szablonu:
Sekwencja aminokwasowa peptydu:
rodzaj mutacji:
uzupełniająca sekwencja DNA:
Sekwencja mRNA transkrybowana z szablonu:
Sekwencja aminokwasowa peptydu:
rodzaj mutacji: