to, jak elementy oddziałują ze sobą zależy od tego, jak ich elektrony są ułożone i ile otworów dla elektronów istnieje w najbardziej oddalonym regionie, w którym elektrony są obecne w atomie. Elektrony istnieją na poziomach energetycznych, które tworzą powłoki wokół jądra. Najbliższa powłoka może pomieścić do dwóch elektronów. Najbliższa powłoka do jądra jest zawsze wypełniana jako pierwsza, zanim każda inna powłoka może być wypełniona. Wodór ma jeden elektron, dlatego ma tylko jedno miejsce zajęte w najniższej powłoce., Hel ma dwa elektrony, dlatego może całkowicie wypełnić najniższą powłokę swoimi dwoma elektronami. Jeśli spojrzysz na układ okresowy, zobaczysz, że wodór i hel są jedynymi dwoma pierwiastkami w pierwszym rzędzie. Dzieje się tak dlatego, że mają tylko elektrony w swojej pierwszej powłoce. Wodór i hel są jedynymi dwoma pierwiastkami, które mają najniższą skorupę i nie mają innych powłok.
drugi i trzeci poziom energii może pomieścić do ośmiu elektronów. Osiem elektronów jest ułożonych w cztery pary i jedna pozycja w każdej parze jest wypełniona elektronem, zanim jakiekolwiek pary zostaną zakończone.,
patrząc ponownie na układ okresowy (Rysunek 1), zauważysz, że jest siedem rzędów. Wiersze te odpowiadają liczbie powłok, które mają elementy w tym wierszu. Pierwiastki w danym rzędzie mają rosnącą liczbę elektronów w miarę przechodzenia kolumn od lewej do prawej. Chociaż każdy element ma taką samą liczbę powłok, nie wszystkie powłoki są całkowicie wypełnione elektronami. Jeśli spojrzysz na drugi rząd układu okresowego, znajdziesz lit (Li), Beryl (Be), Bor (B), węgiel (C), azot (N), tlen (O), fluor (F) i neon (Ne)., Wszystkie one mają elektrony, które zajmują tylko pierwszą i drugą skorupę. Lit ma tylko jeden elektron w swojej zewnętrznej powłoce, Beryl ma dwa elektrony, BOR ma trzy, i tak dalej, dopóki cała powłoka nie zostanie wypełniona ośmioma elektronami, jak to ma miejsce w przypadku neonu.
nie wszystkie elementy mają wystarczającą ilość elektronów, aby wypełnić ich najbardziej zewnętrzne powłoki, ale atom jest najbardziej stabilny, gdy wszystkie pozycje elektronów w zewnętrznej powłoce są wypełnione., Z powodu tych wolnych miejsc w najbardziej oddalonych skorupach widzimy powstawanie wiązań chemicznych lub interakcji między dwoma lub więcej tymi samymi lub różnymi pierwiastkami, które skutkują tworzeniem się cząsteczek. Aby osiągnąć większą stabilność, Atomy będą miały tendencję do całkowitego wypełnienia swoich powłok zewnętrznych i będą wiązać się z innymi pierwiastkami, aby osiągnąć ten cel, dzieląc elektrony, akceptując elektrony z innego atomu lub przekazując elektrony do innego atomu., Ponieważ zewnętrzne powłoki pierwiastków o niskiej liczbie atomowej (do wapnia, o liczbie atomowej 20) mogą pomieścić osiem elektronów, jest to określane jako zasada oktetu. Element może oddawać, akceptować lub dzielić elektrony z innymi pierwiastkami, aby wypełnić swoją zewnętrzną powłokę i spełnić regułę oktetu.
gdy atom nie zawiera jednakowej liczby protonów i elektronów, nazywa się go Jonem. Ponieważ liczba elektronów nie jest równa liczbie protonów, każdy jon ma ładunek netto. Jony dodatnie powstają w wyniku utraty elektronów i nazywane są kationami., Jony ujemne powstają przez uzyskanie elektronów i nazywane są anionami.
na przykład sód ma tylko jeden elektron w swojej zewnętrznej powłoce. Potrzeba mniej energii, aby sód przekazał jeden elektron, niż aby przyjąć siedem więcej elektronów, aby wypełnić zewnętrzną powłokę. Jeśli sód straci elektron, ma teraz 11 protonów i tylko 10 elektronów, pozostawiając go z całkowitym ładunkiem +1. Obecnie nazywany jest jonem sodowym.
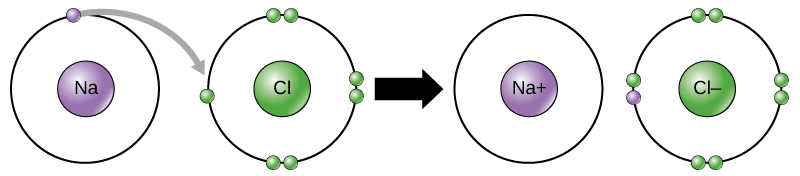
atom chloru ma siedem elektronów w swojej zewnętrznej powłoce. Ponownie, jest bardziej energooszczędne dla chloru zyskać jeden elektron niż stracić siedem., W związku z tym ma tendencję do uzyskiwania elektronu do tworzenia jonu z 17 protonami i 18 elektronami, co daje mu ujemny ładunek netto (-1). Obecnie nazywany jest jonem chlorkowym. Ten ruch elektronów z jednego elementu do drugiego jest określany jako transfer elektronów. Jak ilustruje rysunek 1, atom sodu (Na) ma tylko jeden elektron w swojej zewnętrznej powłoce, podczas gdy atom chloru (Cl) ma siedem elektronów w swojej zewnętrznej powłoce. ATOM sodu podaruje swój jeden elektron, aby opróżnić jego powłokę, a atom chloru zaakceptuje ten elektron, aby wypełnić jego powłokę, stając się chlorkiem., Oba jony spełniają teraz regułę oktetu i mają kompletne powłoki zewnętrzne. Ponieważ liczba elektronów nie jest już równa liczbie protonów, każdy z nich jest teraz Jonem i ma ładunek +1 (sodu) lub -1 (chlorku).

wiązania jonowe
istnieją cztery rodzaje wiązań lub interakcji: jonowe, kowalencyjne, wiązania wodorowe i interakcje van der Waalsa. Wiązania jonowe i kowalencyjne są silnymi oddziaływaniami, które wymagają większego wkładu energii do rozpadu. Kiedy element przekazuje elektron ze swojej zewnętrznej powłoki, jak w powyższym przykładzie atomu sodu, powstaje jon dodatni (ryc. 2). Pierwiastek przyjmujący elektron jest teraz naładowany ujemnie., Ponieważ ładunki dodatnie i ujemne przyciągają, jony te pozostają razem i tworzą wiązanie jonowe lub wiązanie między jonami. Pierwiastki łączą się z elektronem z jednego pierwiastka, pozostając głównie z drugim pierwiastkiem. Kiedy jony Na+ i Cl– łączą się w celu wytworzenia NaCl, elektron z atomu sodu pozostaje z pozostałymi siedmioma z atomu chloru, a jony sodu i chlorku przyciągają się nawzajem w siatce jonów o zerowym ładunku netto.,
wiązania kowalencyjne
innym rodzajem silnego wiązania chemicznego między dwoma lub więcej atomami jest wiązanie kowalencyjne. Wiązania te tworzą się, gdy elektron jest dzielony między dwa elementy i są najsilniejszą i najczęstszą formą wiązania chemicznego w organizmach żywych. Wiązania kowalencyjne tworzą się między pierwiastkami, które tworzą biologiczne cząsteczki w naszych komórkach., W przeciwieństwie do wiązań jonowych, wiązania kowalencyjne nie dysocjują w wodzie.
Co ciekawe, chemicy i biolodzy mierzą siłę wiązania na różne sposoby. Chemicy mierzą bezwzględną siłę wiązania (siłę teoretyczną), podczas gdy biolodzy są bardziej zainteresowani tym, jak Wiązanie zachowuje się w systemie biologicznym, który jest zwykle wodny (na bazie wody). W wodzie wiązania jonowe rozpadają się znacznie łatwiej niż wiązania kowalencyjne, więc biolodzy powiedzieliby, że są słabsze niż wiązania kowalencyjne. Jeśli zajrzysz do podręcznika chemii, zobaczysz coś innego., Jest to świetny przykład tego, jak te same informacje mogą prowadzić do różnych odpowiedzi w zależności od perspektywy, z której je oglądasz.
atomy wodoru i tlenu, które łączą się tworząc cząsteczki wody, są połączone wiązaniami kowalencyjnymi. Elektron z atomu wodoru dzieli swój czas między zewnętrzną powłoką atomu wodoru i niekompletną powłoką zewnętrzną atomu tlenu. Aby całkowicie wypełnić zewnętrzną powłokę atomu tlenu, potrzebne są dwa elektrony z dwóch atomów wodoru, stąd indeks dolny ” 2 ” W H2O., Elektrony są dzielone między Atomy, dzieląc ich czas między nimi, aby „wypełnić” zewnętrzną powłokę każdego z nich. To dzielenie jest niższym stanem energetycznym dla wszystkich atomów zaangażowanych w proces niż gdyby istniały bez wypełnionych powłok zewnętrznych.
istnieją dwa rodzaje wiązań kowalencyjnych: polarne i niepolarne. Niepolarne wiązania kowalencyjne tworzą się między dwoma atomami tego samego pierwiastka lub między różnymi pierwiastkami, które dzielą elektrony jednakowo. Na przykład atom tlenu może wiązać się z innym atomem tlenu, aby wypełnić ich zewnętrzne powłoki., Związek ten jest niepolarny, ponieważ elektrony będą równomiernie rozmieszczone między każdym atomem tlenu. Między dwoma atomami tlenu tworzą się dwa wiązania kowalencyjne, ponieważ tlen wymaga dwóch współdzielonych elektronów, aby wypełnić jego zewnętrzną powłokę. Atomy azotu tworzą trzy wiązania kowalencyjne (zwane również potrójnym kowalencyjnym) między dwoma atomami azotu, ponieważ każdy atom azotu potrzebuje trzech elektronów, aby wypełnić swoją zewnętrzną powłokę. Inny przykład niepolarnego wiązania kowalencyjnego znajduje się w cząsteczce metanu (CH4). Atom węgla ma cztery elektrony w swojej zewnętrznej powłoce i potrzebuje czterech więcej, aby go wypełnić., Otrzymuje te cztery z czterech atomów wodoru, z których każdy dostarcza jeden. Wszystkie te pierwiastki dzielą elektrony jednakowo, tworząc cztery niepolarne wiązania kowalencyjne (ryc. 3).
w polarnym wiązaniu kowalencyjnym elektrony współdzielone przez atomy spędzają więcej czasu bliżej jednego jądra niż drugiego jądra. Z powodu nierównego rozkładu elektronów między różnymi jądrami powstaje ładunek lekko dodatni (δ+) lub lekko ujemny (δ–). Wiązania kowalencyjne między atomami wodoru i tlenu w wodzie są polarnymi wiązaniami kowalencyjnymi., Wspólne elektrony spędzają więcej czasu w pobliżu jądra tlenu, dając mu mały ładunek ujemny, niż spędzają w pobliżu jąder wodoru, dając tym cząsteczkom mały ładunek dodatni.

wiązania wodorowe
wiązania jonowe i kowalencyjne są silnymi wiązaniami, które wymagają znacznej energii do zerwania. Jednak nie wszystkie wiązania między pierwiastkami są wiązaniami jonowymi lub kowalencyjnymi. Mogą również powstawać słabsze wiązania. Są to atrakcje, które występują między dodatnimi i ujemnymi ładunkami, które nie wymagają dużo energii do zerwania. Dwa słabe wiązania, które występują często, to wiązania wodorowe i interakcje van der Waalsa. Wiązania te dają początek unikalnym właściwościom wody oraz unikalnym strukturom DNA i białek.,
gdy polarne wiązania kowalencyjne zawierające atom wodoru tworzą, atom wodoru w tym wiązaniu ma lekko dodatni ładunek. Dzieje się tak dlatego, że wspólny elektron jest przyciągany silniej w kierunku innego pierwiastka i od jądra wodoru. Ponieważ atom wodoru jest nieznacznie dodatni (δ+), zostanie przyciągnięty do sąsiednich ujemnych ładunków cząstkowych (δ–). Gdy tak się dzieje, zachodzi słaba interakcja pomiędzy ładunkiem δ + atomu wodoru jednej cząsteczki i ładunkiem δ drugiej cząsteczki. Oddziaływanie to nazywa się wiązaniem wodorowym., Ten rodzaj wiązania jest powszechny; na przykład ciekły charakter wody jest spowodowany wiązaniami wodorowymi między cząsteczkami wody (ryc. 4). Wiązania wodorowe nadają wodzie unikalne właściwości, które podtrzymują życie. Gdyby nie wiązanie wodorowe, woda byłaby gazem, a nie cieczą w temperaturze pokojowej.

wiązania wodorowe mogą tworzyć się między różnymi cząsteczkami i nie zawsze muszą zawierać cząsteczkę wody. Atomy wodoru w wiązaniach polarnych w obrębie dowolnej cząsteczki mogą tworzyć wiązania z innymi sąsiadującymi cząsteczkami. Na przykład wiązania wodorowe trzymają razem dwie długie nici DNA, aby nadać cząsteczce DNA charakterystyczną dwuniciową strukturę. Wiązania wodorowe są również odpowiedzialne za część trójwymiarowej struktury białek.,
interakcje van der Waalsa
podobnie jak wiązania wodorowe, interakcje van der Waalsa są słabymi atrakcjami lub oddziaływaniami między cząsteczkami. Występują one między polarnymi, kowalencyjnie związanymi atomami w różnych cząsteczkach. Niektóre z tych słabych atrakcji są spowodowane tymczasowymi ładunkami częściowymi powstałymi podczas poruszania się elektronów wokół jądra. Te słabe interakcje między cząsteczkami są ważne w układach biologicznych.