Wie Elemente miteinander interagieren, hängt davon ab, wie ihre Elektronen angeordnet sind und wie viele Öffnungen für Elektronen in der äußersten Region existieren, in der Elektronen in einem Atom vorhanden sind. Elektronen existieren auf Energieniveaus, die Schalen um den Kern bilden. Die nächste Schale kann bis zu zwei Elektronen aufnehmen. Die dem Kern am nächsten gelegene Schale wird immer zuerst gefüllt, bevor eine andere Schale gefüllt werden kann. Wasserstoff hat ein Elektron; Daher hat es nur einen Punkt innerhalb der untersten Schale besetzt., Helium hat zwei Elektronen; Daher kann es die unterste Schale vollständig mit seinen zwei Elektronen füllen. Wenn Sie sich das Periodensystem ansehen, werden Sie feststellen, dass Wasserstoff und Helium die einzigen beiden Elemente in der ersten Reihe sind. Dies liegt daran, dass sie nur Elektronen in ihrer ersten Schale haben. Wasserstoff und Helium sind die einzigen beiden Elemente, die die niedrigste Schale und keine anderen Schalen haben.
Das zweite und dritte Energieniveau können bis zu acht Elektronen aufnehmen. Die acht Elektronen sind in vier Paaren angeordnet und eine Position in jedem Paar ist mit einem Elektron gefüllt, bevor irgendwelche Paare abgeschlossen sind.,
Wenn Sie sich das Periodensystem erneut ansehen (Abbildung 1), werden Sie feststellen, dass es sieben Zeilen gibt. Diese Zeilen entsprechen der Anzahl der Shells, die die Elemente in dieser Zeile haben. Die Elemente innerhalb einer bestimmten Zeile haben eine zunehmende Anzahl von Elektronen, wenn die Spalten von links nach rechts verlaufen. Obwohl jedes Element die gleiche Anzahl von Schalen hat, sind nicht alle Schalen vollständig mit Elektronen gefüllt. Wenn Sie sich die zweite Zeile des Periodensystems ansehen, finden Sie Lithium (Li), Beryllium (Be), Bor (B), Kohlenstoff (C), Stickstoff (N), Sauerstoff (O), Fluor (F) und Neon (Ne)., Diese haben alle Elektronen, die nur die erste und zweite Schale einnehmen. Lithium hat nur ein Elektron in seiner äußersten Schale, Beryllium hat zwei Elektronen, Bor hat drei und so weiter, bis die gesamte Schale mit acht Elektronen gefüllt ist, wie es bei Neon der Fall ist.
Nicht alle Elemente haben genügend Elektronen, um ihre äußersten Schalen zu füllen, aber ein Atom ist am stabilsten, wenn alle Elektronenpositionen in der äußersten Schale gefüllt sind., Aufgrund dieser offenen Stellen in den äußersten Schalen sehen wir die Bildung chemischer Bindungen oder Wechselwirkungen zwischen zwei oder mehr derselben oder verschiedener Elemente, die zur Bildung von Molekülen führen. Um eine größere Stabilität zu erreichen, neigen Atome dazu, ihre äußeren Schalen vollständig zu füllen und sich mit anderen Elementen zu verbinden, um dieses Ziel zu erreichen, indem sie Elektronen teilen, Elektronen von einem anderen Atom annehmen oder Elektronen an ein anderes Atom spenden., Da die äußersten Schalen der Elemente mit niedrigen Ordnungszahlen (bis zu Calcium, mit Ordnungszahl 20) acht Elektronen aufnehmen können, wird dies als Oktettregel bezeichnet. Ein Element kann Elektronen spenden, annehmen oder mit anderen Elementen teilen, um seine äußere Hülle zu füllen und die Oktettregel zu erfüllen.
Wenn ein Atom nicht die gleiche Anzahl von Protonen und Elektronen enthält, wird es als Ion bezeichnet. Da die Anzahl der Elektronen nicht gleich der Anzahl der Protonen ist, hat jedes Ion eine Nettoladung. Positive Ionen werden durch Verlust von Elektronen gebildet und Kationen genannt., Negative Ionen werden durch Gewinnen von Elektronen gebildet und werden Anionen genannt.
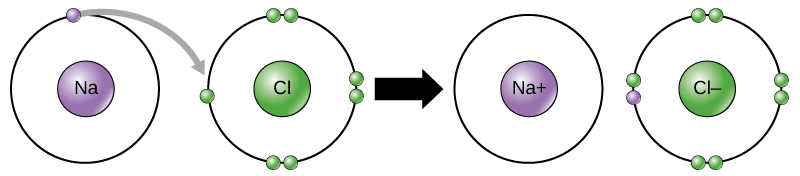
Natrium hat beispielsweise nur ein Elektron in seiner äußersten Hülle. Es braucht weniger Energie für Natrium, um dieses eine Elektron zu spenden, als es sieben weitere Elektronen zu akzeptieren, um die äußere Hülle zu füllen. Wenn Natrium ein Elektron verliert, hat es jetzt 11 Protonen und nur 10 Elektronen und hinterlässt eine Gesamtladung von +1. Es wird jetzt Natriumion genannt.
Das Chloratom hat sieben Elektronen in seiner äußeren Hülle. Auch hier ist es für Chlor energieeffizienter, ein Elektron zu gewinnen, als sieben zu verlieren., Daher neigt es dazu, ein Elektron zu gewinnen, um ein Ion mit 17 Protonen und 18 Elektronen zu erzeugen, wodurch es eine negative Nettoladung (-1) erhält. Es wird jetzt Chloridion genannt. Diese Bewegung von Elektronen von einem Element zum anderen wird als Elektronentransfer bezeichnet. Wie Abbildung 1 zeigt, hat ein Natriumatom (Na) nur ein Elektron in seiner äußersten Hülle, während ein Chloratom (Cl) sieben Elektronen in seiner äußersten Hülle hat. Ein Natriumatom spendet sein ein Elektron, um seine Schale zu leeren, und ein Chloratom akzeptiert dieses Elektron, um seine Schale zu füllen, und wird Chlorid., Beide Ionen erfüllen jetzt die Oktettregel und haben vollständige äußerste Schalen. Da die Anzahl der Elektronen nicht mehr gleich der Anzahl der Protonen ist, ist jedes jetzt ein Ion und hat eine +1 (Natrium) oder -1 (Chlorid) Ladung.

Ionische Bindungen
Es gibt vier Arten von Bindungen oder Wechselwirkungen: Ionische, kovalente, Wasserstoffbrücken und van-der-Waals-Wechselwirkungen. Ionische und kovalente Bindungen sind starke Wechselwirkungen, die einen größeren Energieeinsatz erfordern, um auseinanderzubrechen. Wenn ein Element ein Elektron aus seiner äußeren Hülle spendet, wie im obigen Beispiel des Natriumatoms, wird ein positives Ion gebildet (Abbildung 2). Das Element, das das Elektron annimmt, ist jetzt negativ geladen., Da positive und negative Ladungen anziehen, bleiben diese Ionen zusammen und bilden eine Ionenbindung oder eine Bindung zwischen Ionen. Die Elemente verbinden sich mit dem Elektron von einem Element, überwiegend mit dem anderen Element. Wenn sich Na+ – und Cl– Ionen zu NaCl verbinden, bleibt ein Elektron aus einem Natriumatom mit den anderen sieben aus dem Chloratom, und die Natrium-und Chloridionen ziehen sich in einem Gitter von Ionen mit einer Netto-Nullladung an.,
Kovalente Bindungen
Eine andere Art starker chemischer Bindung zwischen zwei oder mehr Atomen ist eine kovalente Bindung. Diese Bindungen bilden sich, wenn ein Elektron zwischen zwei Elementen geteilt wird und sind die stärkste und häufigste Form der chemischen Bindung in lebenden Organismen. Kovalente Bindungen bilden sich zwischen den Elementen, aus denen die biologischen Moleküle in unseren Zellen bestehen., Im Gegensatz zu Ionenbindungen dissoziieren kovalente Bindungen nicht in Wasser.
Interessanterweise messen Chemiker und Biologen die Bindungsstärke auf unterschiedliche Weise. Chemiker messen die absolute Stärke einer Bindung (die theoretische Stärke), während Biologen mehr daran interessiert sind, wie sich die Bindung in einem biologischen System verhält, das normalerweise wässrig (auf Wasserbasis) ist. Im Wasser kommen ionische Bindungen viel leichter auseinander als kovalente Bindungen, so dass Biologen sagen würden, dass sie schwächer sind als kovalente Bindungen. Wenn Sie in ein Chemielehrbuch schauen, werden Sie etwas anderes sehen., Dies ist ein großartiges Beispiel dafür, wie dieselben Informationen je nach Perspektive, aus der Sie sie anzeigen, zu unterschiedlichen Antworten führen können.
Die Wasserstoff – und Sauerstoffatome, die sich zu Wassermolekülen verbinden, sind durch kovalente Bindungen miteinander verbunden. Das Elektron aus dem Wasserstoffatom teilt seine Zeit zwischen der äußeren Hülle des Wasserstoffatoms und der unvollständigen äußeren Hülle des Sauerstoffatoms. Um die äußere Hülle eines Sauerstoffatoms vollständig zu füllen, werden zwei Elektronen aus zwei Wasserstoffatomen benötigt, daher der Index „2“ in H2O., Die Elektronen werden zwischen den Atomen geteilt und teilen ihre Zeit zwischen ihnen auf, um die äußere Hülle von jedem zu „füllen“. Diese Aufteilung ist ein niedrigerer Energiezustand für alle beteiligten Atome, als wenn sie ohne ihre äußeren Schalen gefüllt existierten.
Es gibt zwei Arten von kovalenten Bindungen: polar und unpolar. Unpolare kovalente Bindungen bilden sich zwischen zwei Atomen desselben Elements oder zwischen verschiedenen Elementen, die die Elektronen gleichmäßig teilen. Zum Beispiel kann sich ein Sauerstoffatom mit einem anderen Sauerstoffatom verbinden, um ihre äußeren Schalen zu füllen., Diese Assoziation ist unpolar, da die Elektronen gleichmäßig zwischen jedem Sauerstoffatom verteilt sind. Zwischen den beiden Sauerstoffatomen bilden sich zwei kovalente Bindungen, da Sauerstoff zwei gemeinsame Elektronen benötigt, um seine äußerste Hülle zu füllen. Stickstoffatome bilden drei kovalente Bindungen (auch Triple covalent genannt) zwischen zwei Stickstoffatomen, da jedes Stickstoffatom drei Elektronen benötigt, um seine äußerste Hülle zu füllen. Ein weiteres Beispiel für eine unpolare kovalente Bindung findet sich im Methan (CH4) – Molekül. Das Kohlenstoffatom hat vier Elektronen in seiner äußersten Hülle und benötigt vier weitere, um es zu füllen., Es erhält diese vier aus vier Wasserstoffatomen, wobei jedes Atom eines bereitstellt. Diese Elemente teilen sich alle Elektronen gleichmäßig und erzeugen vier unpolare kovalente Bindungen (Abbildung 3).
In einer polaren kovalenten Bindung verbringen die Elektronen, die von den Atomen geteilt werden, mehr Zeit näher an einem Kern als am anderen Kern. Aufgrund der ungleichen Verteilung der Elektronen zwischen den verschiedenen Kernen entwickelt sich eine leicht positive (δ+) oder leicht negative (δ–) Ladung. Die kovalenten Bindungen zwischen Wasserstoff – und Sauerstoffatomen in Wasser sind polare kovalente Bindungen., Die geteilten Elektronen verbringen mehr Zeit in der Nähe des Sauerstoffkerns und geben ihm eine kleine negative Ladung, als sie in der Nähe der Wasserstoffkerne verbringen, was diesen Molekülen eine kleine positive Ladung verleiht.

Wasserstoffbrücken
Ionische und kovalente Bindungen sind starke Bindungen, die erhebliche Energie erfordern, um zu brechen. Allerdings sind nicht alle Bindungen zwischen Elementen ionische oder kovalente Bindungen. Schwächere Bindungen können sich ebenfalls bilden. Dies sind Reize, die zwischen positiven und negativen Ladungen auftreten, die nicht viel Energie benötigen, um zu brechen. Zwei schwache Bindungen, die häufig auftreten, sind Wasserstoffbrücken und Van-der-Waals-Wechselwirkungen. Diese Bindungen führen zu den einzigartigen Eigenschaften von Wasser und den einzigartigen Strukturen von DNA und Proteinen.,
Wenn sich polare kovalente Bindungen bilden, die ein Wasserstoffatom enthalten, hat das Wasserstoffatom in dieser Bindung eine leicht positive Ladung. Dies liegt daran, dass das geteilte Elektron stärker in Richtung des anderen Elements und weg vom Wasserstoffkern gezogen wird. Da das Wasserstoffatom leicht positiv (δ+) ist, wird es von benachbarten negativen Teilladungen (δ–) angezogen. In diesem Fall tritt eine schwache Wechselwirkung zwischen der δ+ – Ladung des Wasserstoffatoms eines Moleküls und der δ– Ladung des anderen Moleküls auf. Diese Wechselwirkung wird als Wasserstoffbindung bezeichnet., Diese Art der Bindung ist üblich; Zum Beispiel wird die flüssige Natur von Wasser durch die Wasserstoffbrücken zwischen Wassermolekülen verursacht (Abbildung 4). Wasserstoffbindungen verleihen Wasser die einzigartigen Eigenschaften, die das Leben erhalten. Ohne Wasserstoffbindung wäre Wasser eher ein Gas als eine Flüssigkeit bei Raumtemperatur.

Wasserstoffbrücken können sich zwischen verschiedenen Molekülen bilden und müssen nicht immer ein Wassermolekül enthalten. Wasserstoffatome in polaren Bindungen innerhalb eines Moleküls können Bindungen mit anderen benachbarten Molekülen bilden. Zum Beispiel halten Wasserstoffbrücken zwei lange DNA-Stränge zusammen, um dem DNA-Molekül seine charakteristische doppelsträngige Struktur zu verleihen. Wasserstoffbrücken sind auch für einen Teil der dreidimensionalen Struktur von Proteinen verantwortlich.,
van der Waals Wechselwirkungen
Wie Wasserstoffbrücken sind van der Waals Wechselwirkungen schwache Anziehungen oder Wechselwirkungen zwischen Molekülen. Sie treten zwischen polaren, kovalent gebundenen Atomen in verschiedenen Molekülen auf. Einige dieser schwachen Anziehungen werden durch temporäre Teilladungen verursacht, die entstehen, wenn sich Elektronen um einen Kern bewegen. Diese schwachen Wechselwirkungen zwischen Molekülen sind in biologischen Systemen wichtig.