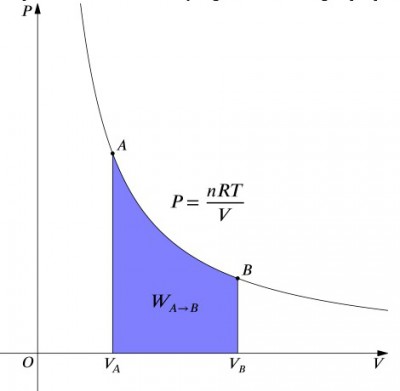
Tlak, objem diagram izotermické proces.
Izotermická látka označuje proces, při kterém se systém mění—ať už se jedná o tlak, objem a/nebo obsah—bez změny teploty. Z hlediska prvního zákona termodynamiky to znamená, že vnitřní energie systému se nemění, protože teplota je měřítkem průměrné kinetické energie molekul v systému., To pak vypadá takto:
a proto
kde:
- je změna vnitřní energie
- je teplo
- práce
Co tato rovnice znamená, že práce vstup do systému musí být přesně dáno tepelným výkonem, a naopak. Pokud je izolovaná nádoba obsahující vzduch stlačena (snižuje její objem, kladnou hodnotu), musí být ze systému odstraněno teplo v souladu (záporná hodnota). Naproti tomu, pokud je nádoba povolena k expanzi (negativní), musí být do systému přidáno teplo, aby se udržela konstantní teplota., Pro výpočet práce musí být provedena integrace do vzorce . To lze také považovat za výpočet plochy pod křivkou. Vzhledem k tvaru křivky však není tak jednoduchý výpočet-například ve srovnání s izobarickým procesem., Vzorec níže je integrovaný rovnice a vypočítá práci pro všechny ději:
kde:
- je počet molů,
- je ideální plynová konstanta
- je počáteční tlak
- je konečný objem
účinnost carnotova cyklu, vysvětlující maximální tepelnou účinnost tepelného motoru je odvozen pomocí izotermické procesy, v nichž termodynamický cyklus je dokončen s použitím 2 izotermických a 2 adiabatické procesy., Fázové změny jsou příkladem izotermických procesů, protože teplota zůstává konstantní, dokud není změna fáze dokončena.
následující video z chemického oddělení UC Berkley vysvětluje myšlenku izotermického procesu s vizuály.