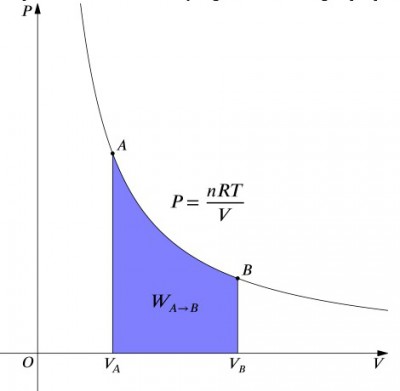
Tryk-volumen diagram for en isoterm proces.
isotermisk henviser til en proces, hvor et system ændres—uanset om det er tryk, volumen og/eller indhold—uden at temperaturen ændres. Ud fra termodynamikens første lov betyder det, at systemets indre energi er uændret, da temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler i systemet., Dette så ser sådan ud:
derfor
hvor:
- er ændringen i indre energi
- er varme
- arbejde
Hvad disse ligninger mener, er, at arbejdet input til et system, der skal være præcis, afbalanceret af en varmeydelse, og vice versa. Hvis en isoleret beholder indeholdende luft komprimeres (faldende volumen, positiv værdi), skal varme fjernes fra systemet i overensstemmelse (negativ værdi). I modsætning hertil, hvis en beholder får lov til at ekspandere (negativ), skal der tilsættes varme til systemet for at holde temperaturen konstant., For at beregne arbejde skal der udføres en integration til formlen . Dette kan også betragtes som beregning af området under kurven. På grund af kurvens form er det imidlertid ikke så enkelt med en beregning—i sammenligning med en isobarisk proces, for eksempel., Nedenstående formel er den integrerede ligning, og vil beregne det arbejde, der udføres for enhver isoterm proces:
hvor:
- er antallet af mol
- er ideel gas konstant
- er det indledende pres
- er den sidste bog
Carnot effektivitet, der forklarer den maksimale termiske effektivitet af en varme motor er fremstillet ved hjælp af isoterm processer, hvor en termodynamiske cyklus er afsluttet med brug af 2 isoterm og 2 adiabatiske processer., Faseændringer er et eksempel på isotermiske processer, da temperaturen forbliver konstant, indtil faseændringen er afsluttet.
følgende video fra UC Berkleys kemiafdeling forklarer ideen om en isotermisk proces med visuals.