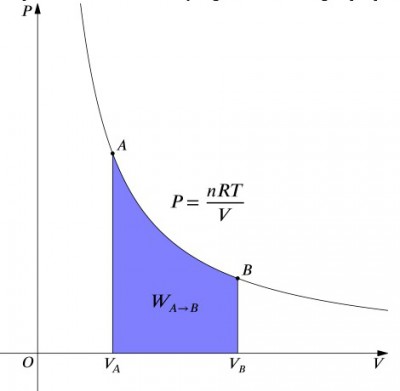
Il diagramma del volume di pressione di un processo isotermico.
Isotermico si riferisce a un processo in cui un sistema cambia—sia che si tratti della pressione, del volume e / o del contenuto—senza che la temperatura cambi. Dal punto di vista della prima legge della termodinamica, ciò significa che l’energia interna del sistema è invariata, poiché la temperatura è una misura dell’energia cinetica media delle molecole all’interno del sistema., Questo appare quindi come:
e di conseguenza,
dove:
- è il cambiamento di energia interna
- è calore
- è lavoro
Ciò che significano queste equazioni è che l’input di lavoro di un sistema deve essere esattamente bilanciato da una potenza termica e viceversa. Se un contenitore isolato contenente aria viene compresso (diminuendo il suo volume, valore positivo), il calore deve essere rimosso dal sistema in conformità (valore negativo). Al contrario, se un contenitore può espandersi (negativo), è necessario aggiungere calore al sistema per mantenere costante la temperatura., Per calcolare il lavoro, è necessario eseguire un’integrazione alla formula . Questo può anche essere pensato come calcolare l’area sotto la curva. Tuttavia, a causa della forma della curva, non è così semplice di un calcolo—in confronto a un processo isobarico, per esempio., La formula di seguito è integrato equazione e calcolare il lavoro fatto per qualsiasi isotermica processo:
in cui:
- è il numero di moli
- è l’ideale costante dei gas
- è la pressione iniziale
- è il volume finale
L’efficienza di Carnot spiegando la massima efficienza termica di un motore termico è ottenuto utilizzando isotermica processi, in cui un ciclo termodinamico è completato con l’utilizzo di 2 isotermica e 2 adiabatica processi., I cambiamenti di fase sono un esempio di processi isotermici, poiché la temperatura rimane costante fino al completamento del cambiamento di fase.
Il seguente video dal dipartimento di chimica di UC Berkley spiega l’idea di un processo isotermico con immagini.