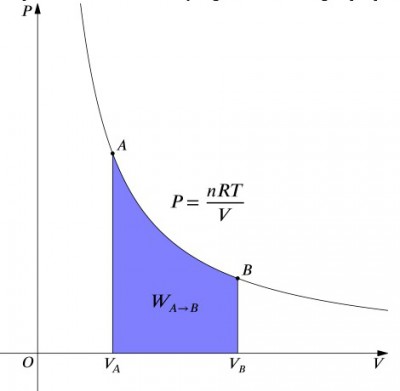
egy izotermikus folyamat nyomástérfogat-diagramja.
az izotermikus olyan folyamatra utal, amelyben a rendszer megváltozik—legyen az nyomás, térfogat és/vagy tartalom—a hőmérséklet változása nélkül. A termodinamika első törvénye szempontjából ez azt jelenti, hogy a rendszer belső energiája változatlan, mivel a hőmérséklet a molekulák átlagos kinetikus energiájának mértéke a rendszerben., Ez így néz ki:
és következésképpen,
ahol:
- a belső energia változása
- a hő
- a munka
ezek az egyenletek azt jelentik, hogy a rendszer bemenetét pontosan ki kell egyensúlyozni hőteljesítménnyel, és fordítva. Ha a levegőt tartalmazó szigetelt tartályt összenyomják (csökkentve annak térfogatát, pozitív értékét), akkor a hőt el kell távolítani a rendszerből (negatív érték). Ezzel szemben, ha egy tartály kibővíthető (negatív), akkor a hőmérséklet állandó fenntartása érdekében hőt kell hozzáadni a rendszerhez., A munka kiszámításához integrációt kell végezni a képlettel . Ezt úgy is gondolhatjuk, mint a görbe alatti terület kiszámítását. A görbe alakja miatt azonban nem olyan egyszerű a számítás—például egy izobár folyamathoz képest., A képlet az alábbiakban az integrált egyenlet, pedig kiszámítja a munka minden izoterm folyamat:
, ahol:
- a száma, mol
- az ideális gáz állandó
- a kezdeti nyomás
- az utolsó kötet
A Carnot-hatásfok elmagyarázza a maximális termikus hatásfoka egy hőerőgép származik segítségével izoterm folyamatok, amelyek egy termodinamikai ciklus befejeződött a használata 2 izoterm, 2 adiabatikus folyamatok., A fázisváltozások az izotermikus folyamatok példája, mivel a hőmérséklet állandó marad a fázisváltozás befejezéséig.
az UC Berkley Kémiai Tanszékének következő videója ismerteti az izotermikus folyamat gondolatát vizualizációkkal.