Isotermisk refererer til en prosess der et system endringer—enten det er på trykk, volum og/eller innholdet—uten at temperaturen endrer seg. Fra synspunkt av den første loven av termodynamikk, dette betyr at den indre energien i systemet er uendret, ettersom temperatur er et mål på den gjennomsnittlige kinetiske energien til molekylene i systemet., Dette ser ut som:
og det er følgelig
hvor:
- er endringen i intern energi
- er varme
- er arbeid
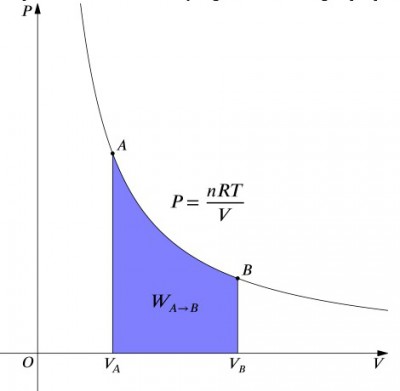
Hva disse ligningene mener er at arbeidet med innspill til et system må være nøyaktig, balansert med en varmeeffekt, og vice versa. Hvis en isolert beholder som inneholder luften er komprimert (redusere volumet, positiv verdi), så varme som må fjernes fra systemet i samsvar (negativ verdi). I motsetning, hvis en beholder er lov til å utvide (negative ), så varme må være lagt inn i systemet for å holde temperaturen konstant., For å beregne arbeid, en integrasjon som må gjøres for å formelen . Dette kan også oppfattes som å beregne arealet under kurven. Imidlertid, på grunn av formen på kurven, det er ikke så enkelt for en beregning i forhold til en isobaric prosessen, for eksempel., Formelen nedenfor er integrert ligningen, og vil beregne arbeidet som er gjort for alle isotermisk prosessen:
hvor:
- er nummeret av føflekker
- er ideell gass konstant
- er det første trykket
- er endelig volum
Carnot-virkningsgraden forklarer maksimal termisk effektivitet av en varme motoren er avledet ved hjelp av isotermisk prosesser, der en termodynamisk syklus er ferdig med bruk av 2 isotermisk og 2 adiabatic prosesser., Fase endringer er et eksempel på isotermiske prosesser, siden temperaturen holder seg konstant til fase endringen er fullført.
følgende video fra UC Berkley ‘ s kjemi avdeling forklarer ideen om en isotermisk prosessen med grafikk.