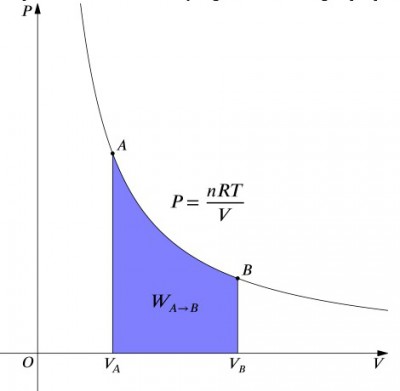
O diagrama do volume de pressão de um processo isotérmico.
isotérmica refere—se a um processo no qual um sistema muda—seja a pressão, volume e/ou conteúdo-sem a mudança de temperatura. Do ponto de vista da primeira lei da termodinâmica, isto significa que a energia interna do sistema é inalterada, uma vez que a temperatura é uma medida da energia cinética média das moléculas dentro do sistema., Este aspecto, em seguida,:
e, consequentemente,
em que:
- é a mudança na energia interna
- é o calor
- trabalho
o Que estas equações dizer é que o trabalho de entrada para um sistema deve ser exatamente equilibrada por uma saída de calor, e vice-versa. Se um recipiente isolado contendo ar for comprimido (diminuindo o seu volume, valor positivo), o calor deve ser removido do sistema de acordo com o valor negativo. Em contraste, se um recipiente é permitido expandir (negativo), então o calor deve ser adicionado ao sistema, a fim de manter a temperatura constante., Para calcular o trabalho, uma integração deve ser feita à fórmula . Isto também pode ser pensado como o cálculo da área sob a curva. No entanto, devido à forma da curva, não é tão simples de um cálculo—em comparação com um processo isobárico, por exemplo., A fórmula abaixo é integrado equação, e irá calcular o trabalho realizado por qualquer processo isotérmico:
, onde:
- é o número de moles
- é o gás ideal constante
- é a pressão inicial
- é o volume final
O Carnot, a eficiência explicando o máximo de eficiência térmica de um motor térmico é derivada usando isotérmica de processos, em que um ciclo termodinâmico é completada com o uso de 2 isotérmica e 2 adiabática processos., Mudanças de fase são um exemplo de processos isotérmicos, uma vez que a temperatura permanece constante até que a mudança de fase esteja completa. o vídeo seguinte do Departamento de química de UC Berkley explica a ideia de um processo isotérmico com visuais.