tryckvolymdiagrammet för en isotermisk process.
isotermisk hänvisar till en process där ett system ändras—oavsett om det är trycket, volymen och / eller innehållet—utan att temperaturen ändras. Ur termodynamikens första lag innebär detta att systemets inre energi är oförändrad, eftersom temperaturen är ett mått på den genomsnittliga kinetiska energin hos molekyler inom systemet., Detta ser då ut som:
och följaktligen
var:
- är förändringen i intern energi
- är värme
- är arbete
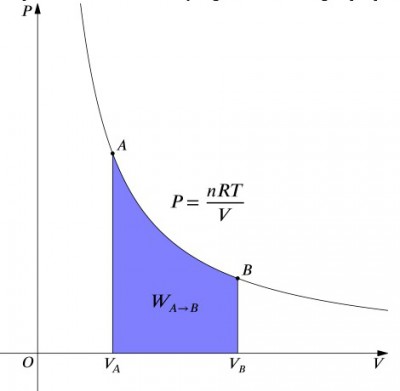
vad dessa ekvationer betyder är att arbetsinmatningen till ett system måste balanseras exakt av en värmeutgång och vice versa. Om en isolerad behållare innehållande luft komprimeras (minskar dess volym, positivt värde), måste värmen avlägsnas från systemet i enlighet (negativt värde). Däremot, om en behållare får expandera (negativ), måste värme läggas till systemet för att hålla temperaturen konstant., För att beräkna arbetet måste en integration göras med formeln . Detta kan också ses som beräkning av området under kurvan. Men på grund av kurvans form är det inte så enkelt att beräkna—i jämförelse med en isobarisk process, till exempel., Formeln nedan är den integrerade ekvationen, och kommer att beräkna det arbete som utförts för någon isotermisk process:
var:
- är antalet mol
- är den ideala gaskonstanten
- är det ursprungliga trycket
- är den slutliga volymen
Carnot-effektiviteten som förklarar den maximala termiska effektiviteten hos en värmemotor härleds genom att använda isotermiska processer, där en termodynamisk cykel är klar med hjälp av isotermiska användningen av 2 isotermiska och 2 adiabatiska processer., Fasförändringar är ett exempel på isotermiska processer, eftersom temperaturen förblir konstant tills fasförändringen är klar.
följande video från UC Berkleys kemiavdelning förklarar idén om en isotermisk process med visuella.