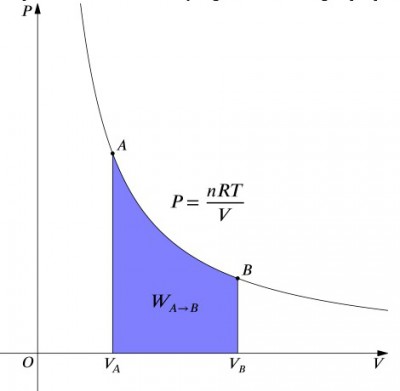
Das Druckvolumendiagramm eines isothermen Prozesses.
Isotherm bezieht sich auf einen Prozess, bei dem sich ein System ändert—sei es der Druck, das Volumen und/oder der Inhalt—ohne dass sich die Temperatur ändert. Aus der Sicht des ersten Hauptsatzes der Thermodynamik bedeutet dies, dass die innere Energie des Systems unverändert ist, da die Temperatur ein Maß für die durchschnittliche kinetische Energie von Molekülen innerhalb des Systems ist., Dies sieht dann so aus:
und folglich
wobei:
- ist die Änderung der inneren Energie
- ist Wärme
- ist Arbeit
Was diese Gleichungen bedeuten, ist, dass die Arbeitseingabe in ein System genau durch eine Wärmeausgabe ausgeglichen werden muss und umgekehrt. Wenn ein isolierter Behälter, der Luft enthält, komprimiert wird (Verringerung seines Volumens, positiver Wert), muss die Wärme entsprechend aus dem System entfernt werden (negativer Wert). Wenn dagegen ein Behälter sich ausdehnen darf (negativ ), muss dem System Wärme zugesetzt werden, um die Temperatur konstant zu halten., Um die Arbeit zu berechnen, muss eine Integration in die Formel erfolgen . Dies kann auch als Berechnung der Fläche unter der Kurve angesehen werden. Aufgrund der Form der Kurve ist es jedoch nicht so einfach zu berechnen—zum Beispiel im Vergleich zu einem isobaren Prozess., Die folgende Formel ist die integrierte Gleichung und berechnet die für jeden isothermen Prozess geleistete Arbeit:
wobei:
- die Anzahl der Mol ist
- ist die ideale Gaskonstante
- ist der Anfangsdruck
- ist das Endvolumen
Die Carnot-Effizienz, die den maximalen thermischen Wirkungsgrad einer Wärmekraftmaschine erklärt, wird durch Verwendung isothermer Prozesse abgeleitet, bei denen ein thermodynamischer Zyklus mit die Verwendung von 2 isothermen und 2 adiabatischen Prozessen., Phasenänderungen sind ein Beispiel für isotherme Prozesse, da die Temperatur konstant bleibt, bis die Phasenänderung abgeschlossen ist.
Das folgende Video von UC Berkley ‚ s Chemistry Department erklärt die Idee eines isothermen Prozesses mit Visuals.