3) Cationi adiacenti di un atomo con coppie elette solitarie.
Poiché gli eteroatomi come l’ossigeno e l’azoto sono più elettronegativi del carbonio, ci si potrebbe aspettare che siano per definizione gruppi di ritiro degli elettroni che destabilizzano i carbocationi. In effetti, spesso è vero il contrario: se l’atomo di ossigeno o azoto è nella posizione corretta, l’effetto complessivo è la stabilizzazione del carbocation., Ciò è dovuto al fatto che sebbene questi eteroatomi siano gruppi di prelievo di elettroni per induzione, sono gruppi di donazione di elettroni per risonanza, ed è questo effetto di risonanza che è più potente. (Abbiamo già incontrato questa stessa idea quando si considera l’acidità relativa e la basicità dei fenoli e delle ammine aromatiche nella sezione 7.4)., Considera che le due coppie di carbocation specie di seguito:
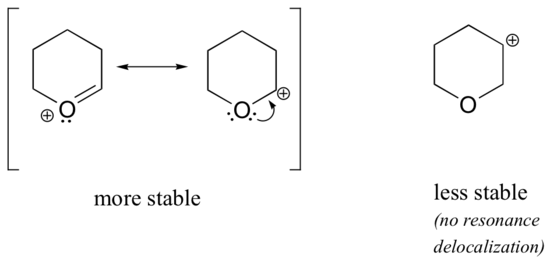
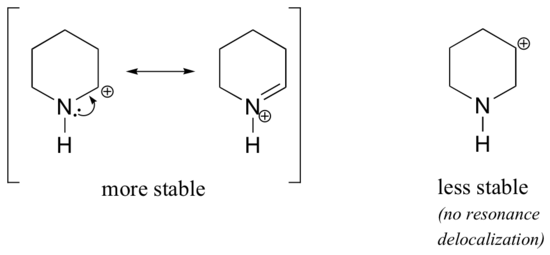
il più stabile relativi carbocationi, l’eteroatomo agisce come un elettrone donazione di gruppo per risonanza: in effetti, la coppia solitaria sul eteroatomo è disponibile per delocalizzare la carica positiva. Nelle carbocazioni meno stabili il carbonio caricato positivamente è più di un legame lontano dall’eteroatomo, e quindi non sono possibili effetti di risonanza., In effetti, in queste specie di carbocation gli eteroatomi destabilizzano effettivamente la carica positiva, perché sono elettroni che si ritirano per induzione