3) Cations adjacents à un atome avec des électons à paire unique.
étant donné que les hétéroatomes tels que l’oxygène et l’azote sont plus électronégatifs que le carbone, on pourrait s’attendre à ce qu’ils soient par définition des groupes de retrait d’électrons qui déstabilisent les carbocations. En fait, le contraire est souvent vrai: si l’atome d’oxygène ou d’azote est dans la bonne position, l’effet global est la stabilisation du carbocation., Cela est dû au fait que bien que ces hétéroatomes soient des groupes de retrait d’électrons par induction, ce sont des groupes de Don d’électrons par résonance, et c’est cet effet de résonance qui est le plus puissant. (Nous avons déjà rencontré cette même idée en considérant l’acidité relative et la basicité des phénols et des amines aromatiques à la section 7.4)., Considérons les deux paires d’espèces de carbocation ci-dessous:
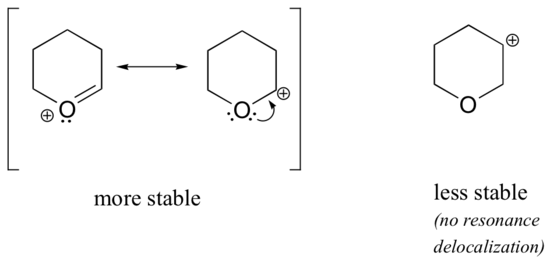
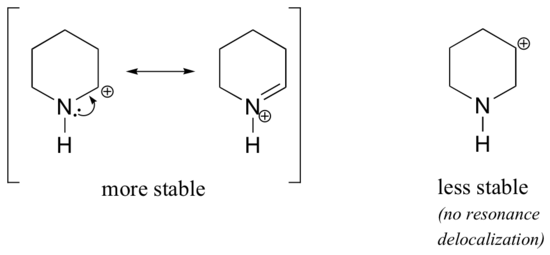
dans les carbocations plus stables, l’hétéroatome agit en tant que groupe donateur d’électrons par résonance: en effet, la seule paire sur l’hétéroatome est disponible pour délocaliser la charge positive. Dans les carbocations moins stables, le carbone chargé positivement est à plus d’une liaison de l’hétéroatome, et donc aucun effet de résonance n’est possible., En fait, chez ces espèces de carbocation, les hétéroatomes déstabilisent réellement la charge positive, car ils se retirent des électrons par induction