3) kationen grenzend aan een atoom met elektronen van een enkel paar.
omdat heteroatomen zoals zuurstof en stikstof meer elektronegatief zijn dan koolstof, zou je kunnen verwachten dat het per definitie elektronentrekkende groepen zijn die carbocaties destabiliseren. In feite is vaak het tegenovergestelde waar: als het zuurstof-of stikstofatoom zich in de juiste positie bevindt, is het totale effect de stabilisatie van de carbokatie., Dit is te wijten aan het feit dat hoewel deze heteroatomen elektronen terugtrekkende groepen zijn door inductie, het zijn elektronen donerende groepen door resonantie, en het is dit resonantie-effect dat krachtiger is. (Ditzelfde idee kwamen we eerder tegen toen we de relatieve zuurgraad en basiciteit van fenolen en aromatische aminen in paragraaf 7.4 beschouwden)., Neem de twee paren van carbocatiesoorten hieronder:
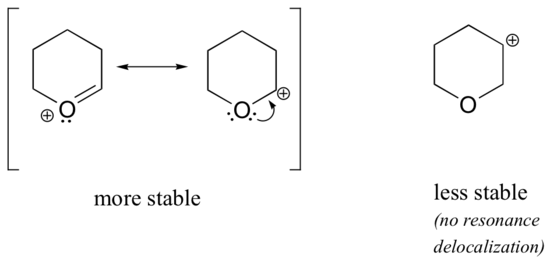
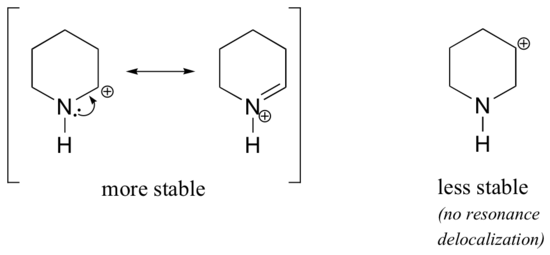
In de stabielere carbokaties werkt het heteroatoom als een elektron donerende groep door resonantie: in feite is het eenzame paar op het heteroatoom beschikbaar om de positieve lading te delokaliseren. In de minder stabiele carbonaties is de positief geladen koolstof meer dan één binding verwijderd van het heteroatoom, en dus zijn er geen resonantie-effecten mogelijk., In feite destabiliseren heteroatomen bij deze carbocatiesoorten de positieve lading, omdat ze elektronen terugtrekken door inductie