izoterma odnosi się do procesu, w którym system zmienia-czy to ciśnienie, objętość i / lub zawartość-bez zmiany temperatury. Z punktu widzenia pierwszego prawa termodynamiki oznacza to, że energia wewnętrzna układu pozostaje niezmieniona, ponieważ temperatura jest miarą średniej energii kinetycznej cząsteczek w układzie., Wygląda to następująco:
i w konsekwencji
gdzie:
- jest zmianą energii wewnętrznej
- jest ciepłem
- jest pracą
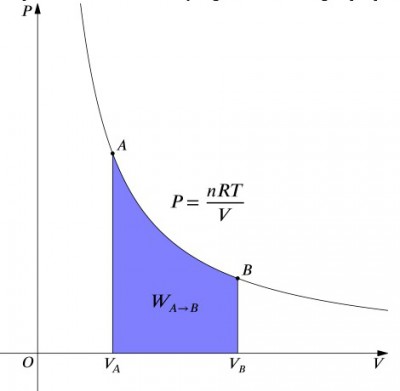
co te równania oznaczają, że wejście pracy do systemu musi być dokładnie zrównoważone przez wyjście ciepła i odwrotnie. Jeśli izolowany pojemnik zawierający powietrze jest sprężony (zmniejszenie jego objętości, wartość dodatnia), to ciepło musi być usunięte z układu zgodnie z (wartość ujemna). W przeciwieństwie do tego, jeśli pojemnik może się rozwinąć (ujemnie), należy dodać ciepło do systemu, aby utrzymać stałą temperaturę., Aby obliczyć pracę, należy wykonać całkowanie ze wzorem . Można to również traktować jako obliczanie pola pod krzywą. Jednak ze względu na kształt krzywej nie jest to tak proste obliczenie—w porównaniu np. do procesu izobarycznego., Poniższy wzór jest równaniem zintegrowanym i obliczy pracę wykonaną dla dowolnego procesu izotermicznego:
gdzie:
- jest liczbą moli
- jest idealną stałą gazową
- jest ciśnieniem początkowym
- jest objętością końcową
sprawność Carnota wyjaśniająca maksymalną sprawność cieplną silnika cieplnego otrzymuje się za pomocą procesów izotermicznych, w których cykl termodynamiczny jest zakończony za pomocą Zastosowanie 2 procesów izotermicznych i 2 adiabatycznych., Zmiany fazowe są przykładem procesów izotermicznych, ponieważ temperatura pozostaje stała aż do zakończenia zmiany faz.
poniższy film z Wydziału Chemii UC Berkley wyjaśnia ideę procesu izotermicznego za pomocą wizualizacji.