3) cationes adyacentes de un átomo con electones de par solitario.
debido a que los heteroátomos como el oxígeno y el nitrógeno son más electronegativos que el carbono, se podría esperar que por definición serían grupos de retiro de electrones que desestabilizan las carbocaciones. De hecho, a menudo ocurre lo contrario: si el átomo de oxígeno o nitrógeno está en la posición correcta, el efecto general es la estabilización de carbocación., Esto se debe al hecho de que aunque estos heteroátomos son grupos de retiro de electrones por inducción, son grupos de donación de electrones por resonancia, y es este efecto de resonancia el que es más poderoso. (Anteriormente encontramos esta misma idea al considerar la acidez relativa y la basicidad de los fenoles y aminas aromáticas en la sección 7.4)., Considere los dos pares de carbocation especies a continuación:
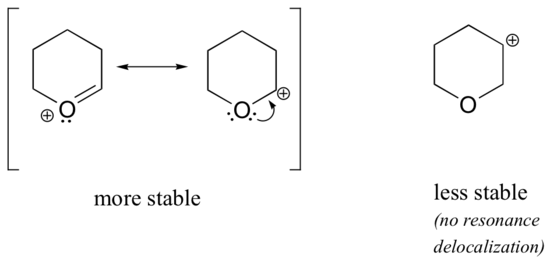
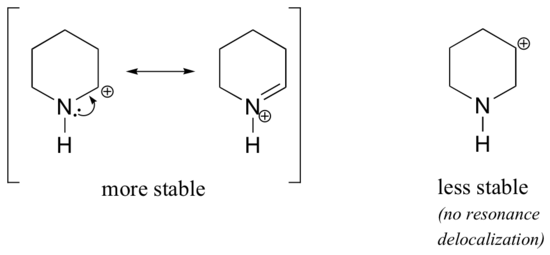
En el más estable carbocations, el heteroátomo actúa como un electrón de la donación de grupo por resonancia: en efecto, el par solitario en el heteroátomo está disponible para deslocalizar la carga positiva. En las carbocaciones menos estables, el carbono cargado positivamente está a más de un enlace del heteroátomo, y por lo tanto no hay efectos de resonancia posibles., De hecho, en estas especies de carbocación, los heteroátomos desestabilizan la carga positiva, porque son electrones que se retiran por inducción