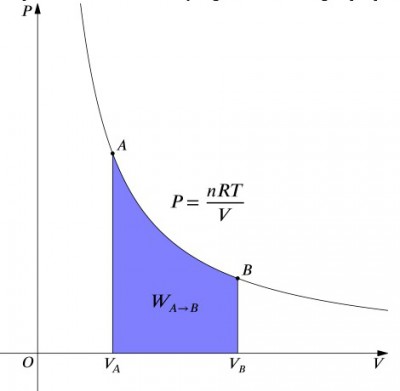
El volumen de Presión diagrama de un proceso isotérmico.
isotérmico se refiere a un proceso en el que un sistema cambia—ya sea la presión, el volumen y/o el contenido—sin cambiar la temperatura. Desde el punto de vista de la primera ley de la termodinámica, esto significa que la energía interna del sistema no cambia, ya que la temperatura es una medida de la energía cinética promedio de las moléculas dentro del sistema., Esto entonces se ve como:
y en consecuencia,
donde:
- Es el cambio en la energía interna
- Es calor
- Es trabajo
lo que estas ecuaciones significan es que la entrada de trabajo a un sistema debe ser exactamente equilibrada por una salida de calor, y viceversa. Si se comprime un recipiente aislado que contiene aire (disminuyendo su volumen, valor positivo), se debe eliminar el calor del sistema de acuerdo con (valor negativo). Por el contrario, si se permite que un contenedor se expanda (negativo), se debe agregar calor al sistema para mantener la temperatura constante., Para calcular el trabajo, se debe hacer una integración a la fórmula . Esto también puede ser considerado como el cálculo del área bajo la curva. Sin embargo, debido a la forma de la curva, no es tan simple de un cálculo—en comparación con un proceso isobárico, por ejemplo., La siguiente fórmula es la ecuación integrada, y calculará el trabajo realizado para cualquier proceso isotérmico:
donde:
- Es el número de moles
- Es la constante de gas ideal
- Es la presión inicial
- Es el volumen final
La eficiencia Carnot explicando la máxima eficiencia térmica de un motor térmico se deriva mediante el uso de procesos isotérmicos, en los que se completa un ciclo termodinámico con el uso de 2 procesos isotérmicos y 2 adiabáticos., Los cambios de fase son un ejemplo de procesos isotérmicos, ya que la temperatura permanece constante hasta que se completa el cambio de fase.
el siguiente video del departamento de química de UC Berkley explica la idea de un proceso isotérmico con visuales.