tanulási célok
- induktív operonok és elnyomható operonok összehasonlítása
- ismertesse, miért fontos az operonok szabályozása
egy többsejtű organizmus minden nukleált sejtje ugyanazon DNS másolatait tartalmazza. Hasonlóképpen, az ugyanazon kiindulási kolóniából beoltott két tiszta bakteriális tenyészet összes sejtje ugyanazt a DNS-t tartalmazza, kivéve a spontán mutációkból eredő változásokat., Ha egy multicelluláris szervezet minden sejtje azonos DNS-vel rendelkezik, akkor hogyan lehet, hogy a szervezet testének különböző részein lévő sejtek eltérő tulajdonságokkal rendelkeznek? Hasonlóképpen, hogyan lehet, hogy ugyanazok a baktériumsejtek két tiszta tenyészetben, amelyek különböző környezeti feltételeknek vannak kitéve, különböző fenotípusokat mutathatnak? Mindkét esetben minden genetikailag azonos sejt nem kapcsol be, vagy nem fejezi ki ugyanazt a génkészletet. Csak egy részhalmaza fehérjék egy sejtben egy adott időpontban expresszálódik.,
a genomikus DNS mind a szerkezeti géneket tartalmazza, amelyek celluláris struktúrákként vagy enzimekként szolgáló termékeket kódolnak, mind a szabályozó géneket, amelyek a gén expresszióját szabályozó termékeket kódolják. A gén expressziója erősen szabályozott folyamat. Mivel a szabályozó gén kifejeződése a többsejtű élőlények lehetővé teszi a mobiltelefon-differenciálás, az egysejtű élőlények, mint prokaryotes, elsősorban biztosítja, hogy egy sejt források nem vész kárba, hogy a fehérjék a sejt nem kell abban az időben.,
a génexpressziót szabályozó mechanizmusok tisztázása fontos az emberi egészség megértéséhez. Ebben a folyamatban az emberekben fellépő működési zavarok a rák és más betegségek kialakulásához vezetnek. A kórokozó és az emberi gazdaszervezet génexpressziója közötti kölcsönhatás megértése fontos egy adott fertőző betegség megértéséhez. A génszabályozás egy adott sejten belüli kölcsönhatások komplex hálóját foglalja magában a sejt környezetéből származó jelek, a sejten belüli jelátviteli molekulák és a sejt DNS között., Ezek a kölcsönhatások bizonyos gének expressziójához, mások elnyomásához vezetnek, a körülményektől függően.
A prokarióták és eukarióták bizonyos hasonlóságokat mutatnak a génexpresszió szabályozására szolgáló mechanizmusaikban; az eukariótákban azonban a génexpresszió bonyolultabb a transzkripciós és fordítási folyamatok időbeli és térbeli szétválasztása miatt., Így, bár a génexpresszió legtöbb szabályozása a prokarióták transzkripciós szabályozásával történik, az eukarióták génexpressziójának szabályozása transzkripciós szinten és post-transcriptionálisan történik (az elsődleges átirat elkészítése után).
prokarióta génszabályozás
baktériumokban és archaeákban a kapcsolódó funkciókkal rendelkező szerkezeti fehérjéket általában a genomban egy operonnak nevezett blokkban kódolják, és egyetlen promoter irányítása alatt írják át őket, ami policisztronos átirat kialakulását eredményezi (1.ábra)., Ily módon az összes olyan szerkezeti gén transzkripciójának szabályozása, amely az enzimeket kódolja, amelyek egyetlen biokémiai úton katalizálják a sok lépést, egyszerre szabályozható, mert mindegyikre egyszerre lesz szükség, vagy egyikre sem lesz szükség. Például az E. coli-ban az összes olyan szerkezeti gén, amely enzimeket kódol, amelyek a laktóz energiaforrásként történő felhasználásához szükségesek, egymás mellett helyezkednek el a laktóz (vagy lac) operonban, egyetlen promoter, a lac promoter irányítása alatt., François Jacob (1920-2013) francia tudósok és Jacques Monod A Pasteur Intézetben elsőként mutatták be a bakteriális gének operonokká történő szervezését az E. coli lac-operonjával kapcsolatos tanulmányaik révén. Ehhez a munkához 1965-ben Nobel-díjat nyertek a fiziológiában vagy az orvostudományban. Bár az eukarióta gének nem szerveződnek operonokba,a prokarióta operonok kiváló modellek a génszabályozás megismerésére. Az eukariótákban vannak olyan génhalmazok, amelyek az operonokhoz hasonlóan működnek., Számos elv alkalmazható az eukarióta rendszerekre, és hozzájárul ahhoz, hogy megértsük a génexpresszió változásait az eukariótákban, amelyek kóros elváltozásokat, például rákot okozhatnak.

1.ábra. A prokariótákban a kapcsolódó funkciók szerkezeti génjeit gyakran együtt szervezik a genomban, és egyetlen promoter irányítása alatt átírják őket. Az operon szabályozási régiója magában foglalja mind a versenyszervezőt, mind az Üzemeltetőt. Ha egy represszor kötődik az operátorhoz, akkor a szerkezeti géneket nem írják át., Alternatív megoldásként az aktivátorok kötődhetnek a szabályozási régióhoz, növelve a transzkripciót.
minden operon magában foglalja a saját transzkripcióját befolyásoló DNS-szekvenciákat; ezek a szabályozási régiónak nevezett régióban találhatók. A szabályozó régió magában foglalja a promoter-t és a promoter-t körülvevő régiót, amelyhez a transzkripciós faktorok, a szabályozó gének által kódolt fehérjék kötődhetnek. A transzkripciós faktorok befolyásolják az RNS polimeráznak a promoterhez való kötődését, és lehetővé teszik annak progresszióját a szerkezeti gének átírására., A represszor olyan transzkripciós tényező, amely elnyomja egy gén transzkripcióját egy külső ingerre adott válaszként azáltal, hogy a szabályozó régióban, az operátornak nevezett DNS-szekvenciához kötődik, amely a promoter RNS-polimeráz kötőhelye és az első szerkezeti gén transzkripciós kezdő helye között helyezkedik el. A represszor kötés fizikailag blokkolja az RNS polimerázt a szerkezeti gének átírásából., Ezzel szemben az aktivátor egy transzkripciós tényező, amely növeli a gén transzkripcióját egy külső ingerre adott válaszként azáltal, hogy megkönnyíti az RNS polimeráz kötődését a promoterhez. Egy induktor, egy harmadik típusú szabályozó molekula, egy kis molekula, amely aktiválja vagy elnyomja a transzkripciót egy represszorral vagy aktivátorral való kölcsönhatással.
a prokariótákban vannak példák olyan operonokra, amelyek géntermékeire meglehetősen következetesen van szükség, és amelyek kifejeződése ezért szabályozatlan., Az ilyen operonok konstitutívan expresszálódnak, ami azt jelenti, hogy azokat folyamatosan átírják és lefordítják, hogy a sejtnek állandó közbenső szintet biztosítsanak a fehérjetermékekben. Ezek a gének kódolják a sejtek fenntartásához szükséges takarítási funkciókban részt vevő enzimeket, beleértve a DNS-replikációt, javítást és expressziót, valamint a mag anyagcseréjében részt vevő enzimeket. Ezzel szemben vannak más prokarióta operonok is, amelyeket csak szükség esetén fejeznek ki, és amelyeket elnyomók, aktivátorok és induktorok szabályoznak.,
gondolj rá
- mik a részek egy operon DNS-szekvenciájában?
- milyen típusú szabályozó molekulák vannak?
elnyomással történő szabályozás
a prokarióta operonokat általában a kompresszorok operátorrégiókhoz való kötődése szabályozza, ezáltal megakadályozva a szerkezeti gének transzkripcióját. Az ilyen operonokat elnyomható operonoknak vagy indukálható operonoknak kell besorolni. Az elnyomható operonok, mint például a triptofán (trp) operon, általában olyan géneket tartalmaznak, amelyek kódolják a bioszintetikus úthoz szükséges enzimeket., Mindaddig, amíg az út terméke, mint a triptofán, továbbra is megköveteli a sejt, az elnyomó operon továbbra is kifejeződik. Amikor azonban a bioszintetikus út terméke felhalmozódik a sejtben, eltávolítva annak szükségességét, hogy a sejt továbbra is többet hozzon létre, az operon kifejeződése elnyomódik. Ezzel szemben az indukálható operonok, mint például az E. coli lac-operonja, gyakran tartalmaznak enzimeket kódoló géneket egy adott szubsztrát, például a laktóz metabolizmusában részt vevő úton., Ezek az enzimek csak akkor szükségesek, ha a szubsztrát rendelkezésre áll, így az operonok expresszióját általában csak a szubsztrát jelenlétében indukálják.
a trp Operon: egy elnyomható Operon
E. coli szintetizálhatja a triptofánt olyan enzimek segítségével, amelyeket a TRP operonban egymás mellett elhelyezkedő öt szerkezeti gén kódol (2.ábra). Ha a környezeti triptofán alacsony, az operon be van kapcsolva. Ez azt jelenti, hogy a transzkripció megkezdődik, a gének expresszálódnak, a triptofán szintetizálódik., Ha azonban a triptofán jelen van a környezetben, a trp operon ki van kapcsolva. A transzkripció nem fordul elő, a triptofán nem szintetizálódik.
Ha a triptofán nincs jelen a sejtben, a represszor önmagában nem kötődik az operátorhoz, ezért az operon aktív, és a triptofán szintetizálódik. Amikor azonban a triptofán felhalmozódik a sejtben, két triptofán molekula kötődik a trp represszor molekulához, amely megváltoztatja alakját, lehetővé téve, hogy kötődjön a trp operátorhoz., A TRP represszor aktív formájának az operátorhoz való kötődése blokkolja az RNS polimerázt a szerkezeti gének átírásából, megállítva az operon expresszióját. Így az operon által vezérelt bioszintetikus út tényleges terméke szabályozza az operon expresszióját.

2.ábra. A triptofán E. coli-ban történő szintéziséhez szükséges öt szerkezeti gén egymás mellett helyezkedik el a trp operonban. Ha a triptofán hiányzik, a represszor fehérje nem kötődik az operátorhoz, a géneket pedig átírják., Amikor a triptofán bőséges, a triptofán megköti a represszor fehérjét az operátor szekvenciában. Ez fizikailag blokkolja az RNS polimerázt a triptofán bioszintézis gének átírásából.
nézze meg ezt a videót, hogy többet megtudjon a trp operonról.
a lac Operon: indukálható Operon
a lac operon egy indukálható operon példája, amely glükóz hiányában is aktiválható (3.ábra)., A lac operon három szerkezeti gént kódol, amelyek szükségesek a diszacharid laktóz környezetből történő megszerzéséhez és feldolgozásához, lebontva azt az egyszerű cukor glükózra és galaktózra. Ahhoz, hogy a lac operon kifejeződjön, laktóznak kell lennie. Ennek van értelme a sejt számára, mert energetikailag pazarló lenne az enzimek létrehozása a laktóz feldolgozására, ha a laktóz nem áll rendelkezésre.
laktóz hiányában a lac represszor kötődik a lac operon operátor régiójához, fizikailag megakadályozza, hogy az RNS polimeráz átírja a szerkezeti géneket., Ha azonban laktóz van jelen,a sejt belsejében lévő laktóz allolaktózsá alakul. Az allolaktóz induktor molekulaként szolgál, amely a represszorhoz kötődik és alakját úgy változtatja meg, hogy már nem képes kötődni az operátor DNS-hez. A represszor laktóz jelenlétében történő eltávolítása lehetővé teszi, hogy az RNS-polimeráz a kezelő régióban mozogjon, és megkezdje a lac szerkezeti gének transzkripcióját.
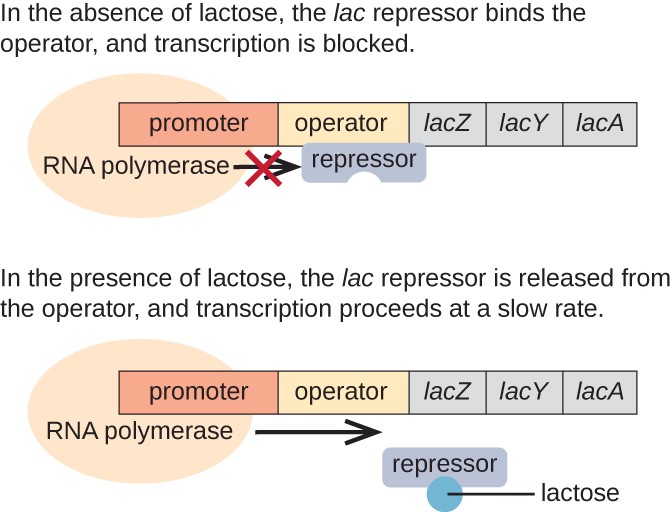
3.ábra. Az E. coli laktóz lebontásához szükséges három szerkezeti gén egymás mellett helyezkedik el a lac operonban., Ha a laktóz hiányzik, a represszor fehérje kötődik a kezelőhöz, fizikailag blokkolja az RNS polimerázt a lac szerkezeti gének átírásából. Amikor laktóz áll rendelkezésre, egy laktóz molekula megköti a represszor fehérjét, megakadályozva, hogy a represszor kötődjön az operátor szekvenciához, és a géneket átírják.
the lac Operon: Activation by Catabolite Activator Protein

4. ábra. Ha két szubsztrát jelenlétében termesztik, az E. coli az előnyben részesített szubsztrátot (ebben az esetben glükózt) használja, amíg kimerül., Ezután a második szubsztrát metabolizmusához szükséges enzimeket expresszálják, a növekedés folytatódik, bár lassabb ütemben.
a baktériumok jellemzően különböző szubsztrátumokat használnak szénforrásként. Mivel azonban a glükóz általában előnyösebb más szubsztrátokhoz képest, a baktériumok mechanizmusokkal rendelkeznek annak biztosítására, hogy az alternatív szubsztrátumokat csak akkor használják, ha a glükóz kimerült. Ezenkívül a baktériumok mechanizmusokkal rendelkeznek annak biztosítására, hogy az alternatív szubsztrátok felhasználására enzimeket kódoló gének csak akkor fejeződjenek ki, ha az alternatív szubsztrát rendelkezésre áll., Az 1940-es években Jacques Monod volt az első, aki az E. coli növekedéséről szóló tanulmányai révén bizonyította bizonyos szubsztrátok előnyben részesítését másokkal szemben, amikor egyszerre két különböző szubsztrát jelenlétében tenyésztették. Az ilyen vizsgálatok diauxikus növekedési görbéket generáltak, mint a 4.ábrán látható. Bár az előnyben részesített szubsztrát glükózt először alkalmazzák, az E. coli gyorsan növekszik, a laktóz metabolizmus enzimjei hiányoznak. Azonban, ha a glükózszint kimerült, a növekedési ütem lassú, ami a második szubsztrát, a laktóz metabolizmusához szükséges enzimek expresszióját idézi elő., Figyeljük meg, hogy a laktóz növekedési üteme lassabb, amint azt a növekedési görbe alacsonyabb meredeksége jelzi.
az a képesség, hogy a glükózhasználatról egy másik szubsztrátra, például a laktózra váltsunk át, az IIA (EIIA) enzim aktivitásának következménye. Amikor a glükózszint csökken, a sejtek kevesebb ATP-t termelnek a katabolizmusból (lásd a szénhidrátok katabolizmusát), az EIIA pedig foszforilálódik., A foszforilált EIIA aktiválja az adenilil-ciklázt, egy enzimet, amely a fennmaradó ATP egy részét ciklikus erősítővé (cAMP) alakítja, amely az AMP ciklikus származéka és fontos jelátviteli molekula, amely részt vesz az E. coli glükóz és energia metabolizmusában. Ennek eredményeként a Tábor szintje emelkedni kezd a cellában(5. ábra).

5.ábra. Amikor az ATP szintje csökken a glükóz kimerülése miatt, a fennmaradó ATP-t adenil-cikláz átalakítja táborba. Így a megnövekedett táborszint jelzi a glükóz kimerülését.,
a lac operon is szerepet játszik ebben a kapcsolóban a glükóz használatáról a laktóz használatára. Ha kevés a glükóz, a megnövekedett adenil-cikláz aktivitás által okozott felhalmozódó tábor kötődik a katabolit aktivátor fehérjéhez (CAP), más néven cAMP receptor protein (CRP). A komplex kötődik a lac operon promoter régiójához (6.ábra). Ezeknek az operonoknak a szabályozási régióiban egy KUPAKKÖTÉSI hely található az RNS-polimeráz-kötőhely előtt a promoterben., A CAP-cAMP komplex kötődése ezen a helyen növeli az RNS polimeráz kötődési képességét a promoter régióhoz a szerkezeti gének transzkripciójának megkezdéséhez. Így a lac operon esetében a transzkripció előfordulásához laktóznak kell lennie (a lac represszor fehérje eltávolítása), és a glükózszintet le kell meríteni (lehetővé téve az aktiváló fehérje kötődését). Ha a glükózszint magas, az alternatív szubsztrátok metabolizmusához enzimeket kódoló operonok katabolit elnyomása van., Az ilyen körülmények között alacsony táborszint miatt a CAP-cAMP komplex nem elegendő ahhoz, hogy aktiválja ezen operonok átírását. A lac operon szabályozásának összefoglalását lásd az 1.táblázatban.

6.ábra. a) cAMP jelenlétében a CAP kötődik az operonok promoterjeihez, mint például a lac operon, amelyek alternatív szubsztrátok alkalmazására szolgáló enzimek génjeit kódolják. b) ahhoz, hogy a lac-operont ki lehessen fejezni, a cAMP-CAP-nak aktiválnia kell, valamint el kell távolítania a lac-represszort az üzemeltetőtől.,
| 1.táblázat.,ion of the lac Operon | ||||
|---|---|---|---|---|
| Glucose | CAP binds | Lactose | Repressor binds | Transcription |
| + | – | – | + | No |
| + | – | + | – | Some |
| – | + | – | + | No |
| – | + | + | – | Yes |
Watch an animated tutorial about the workings of lac operon here.,
gondolj bele
- mi befolyásolja a TRP operon represszor operátorhoz való kötődését?
- hogyan és mikor változik a lac represszor fehérje viselkedése?
- amellett, hogy elnyomó, hogyan más a lac operon szabályozott?
A prokarióták globális válaszai
a prokariótákban több magasabb szintű génszabályozás is létezik, amelyek képesek számos kapcsolódó operon transzkripciójának egyidejű ellenőrzésére egy környezeti jelre adott válaszként., Az egyidejűleg vezérelt operonok egy csoportját regulonnak nevezik.
Alarmones
a közelgő stressz érzékelésekor a prokarióták megváltoztatják az operonok széles skálájának kifejezését, hogy koordinációban reagáljanak. Ezt alarmonok előállításával végzik, amelyek kis intracelluláris nukleotidszármazékok. A riasztók megváltoztatják, hogy mely gének expresszálódnak, és serkentik a specifikus stressz-válasz gének expresszióját. Úgy tűnik, hogy a kórokozó baktériumokban fontos a riasztók használata a gén expressziójának megváltoztatására a stresszre adott válaszként., A gazdaszervezet védelmi mechanizmusainak és a fertőzés során fellépő egyéb zord körülményeknek való megfelelés során számos virulencia gént kódoló operont szabályoznak a riasztási jelre adott válaszként. Ezeknek a válaszoknak a ismerete kulcsfontosságú ahhoz, hogy teljes mértékben megértsük számos kórokozó fertőzési folyamatát, valamint a terápiák kifejlesztését a folyamat ellensúlyozására.,
Alternatív σ Tényezők
Mivel a σ alegység a bakteriális RNS polimeráz biztosít sajátossága, hogy melyik támogatók kell írnia, hogy megváltozik a σ tényező használt egy másik módja a baktériumok számára, hogy gyorsan, de globálisan is a változás, amit regulons vagy átírt egy adott időpontban. A σ-faktor felismeri a szekvenciákat egy bakteriális promoter-en belül, így a különböző σ-faktorok mindegyike kissé eltérő promoter-szekvenciákat ismer fel., Így, amikor a sejt érzékeli, adott környezeti feltételek mellett, lehet, hogy reagálni a változó, amely σ tényező fejezi ki, megalázó, a régi egy termelő egy újat, amit le kell írnia a operons kódoló gének, amelyek termékei hasznos lesz az új környezeti állapota. Például a bacillus és Clostridium nemzetségek sporuláló baktériumaiban (amelyek számos kórokozót tartalmaznak) a σ-tényezők egy csoportja szabályozza a sporulációhoz szükséges sok gén expresszióját a sporulációt stimuláló jelekre reagálva.,
gondolj bele
- mi a neve annak az operonnak, amelyet csoportként lehet szabályozni?
- milyen típusú inger váltaná ki egy másik σ-faktor átírását?
további szabályozási módszerek a baktériumokban: csillapítás és Riboswitches
bár a legtöbb génexpressziót a prokarióták transzkripciós beavatásának szintjén szabályozzák, vannak olyan mechanizmusok is, amelyek szabályozzák mind a transzkripció befejezését, mind a fordítást egyidejűleg., Felfedezésük óta kimutatták, hogy ezek a mechanizmusok számos prokarióta operon transzkripciójának és fordításának befejezését szabályozzák. Mivel ezek a mechanizmusok közvetlenül összekapcsolják a transzkripció és a fordítás szabályozását, specifikusak a prokariótákra, mivel ezeket a folyamatokat eukariótákban fizikailag elválasztják.
az egyik ilyen szabályozási rendszer a csillapítás, amelynek során az mRNS átírásának 5′ végén kialakult másodlagos szárhurok struktúrák meghatározzák, hogy az mRNS szintézisének befejezéséhez transzkripció történik-e, és ha ezt az mRNS-t fordításra használják-e., A már tárgyalt transzkripciós elnyomási mechanizmuson túl a csillapítás az E. coli TRP operon expresszióját is szabályozza (7.ábra). A trp operon regulatory region egy trpl nevű leader szekvenciát tartalmaz az operátor és az első szerkezeti gén között,amelynek négy RNS-szakasza van, amelyek különböző kombinációkban képesek egymással párosítani. Amikor egy terminátor szár-hurok alakul ki, a transzkripció megszűnik, felszabadítva az RNS polimerázt az mRNS-ből., Ha azonban anterminátor szár-hurok alakul ki, ez megakadályozza a Terminátor szár-hurok kialakulását, így az RNS polimeráz átírhatja a szerkezeti géneket.
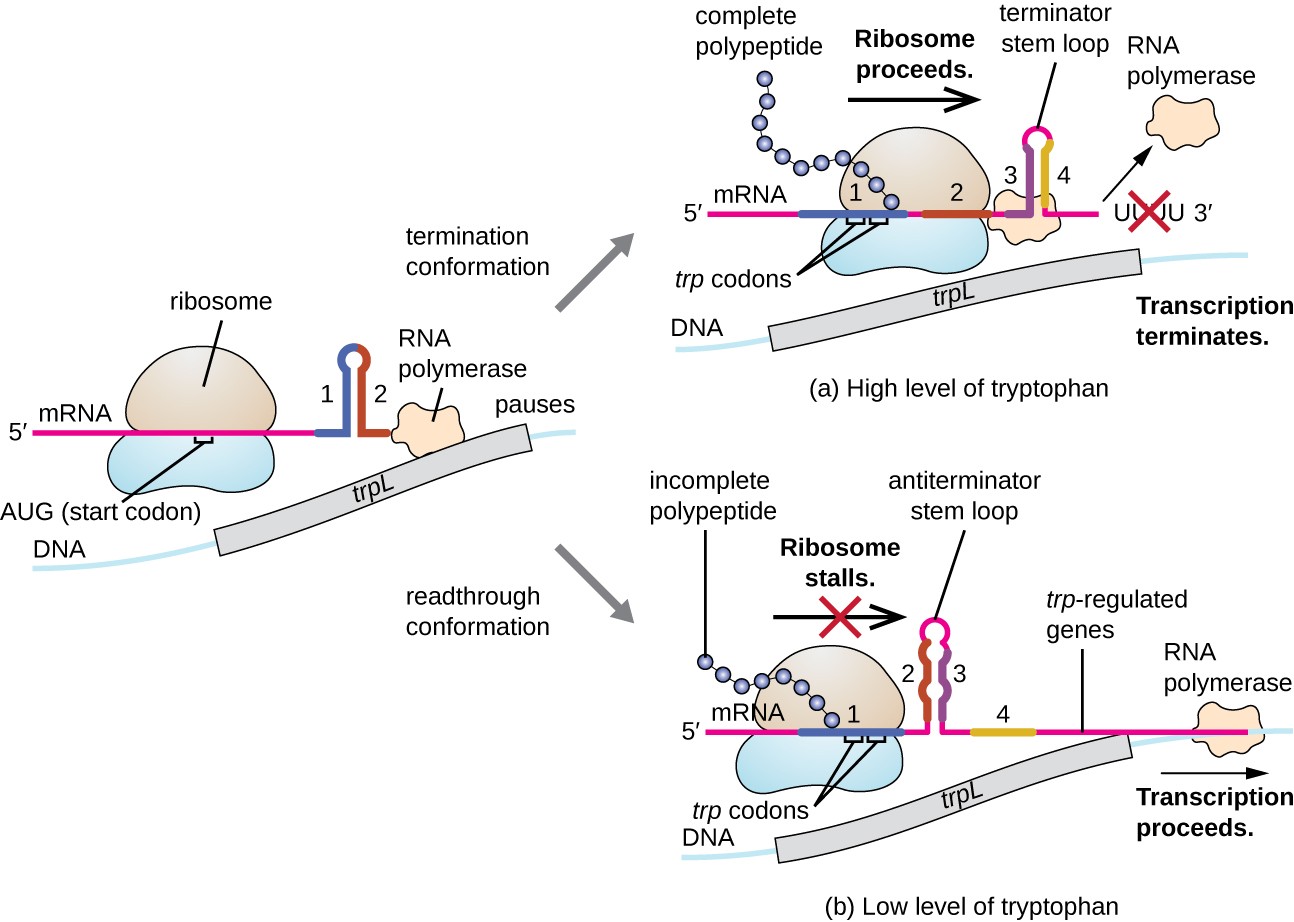
7.ábra. Kattintson a nagyobb kép megtekintéséhez. Ha a triptofán bőséges, akkor a trpl által kódolt rövid leader peptid fordítása, a 3.és 4. régió közötti Terminátor hurok, és a transzkripció megszűnik., Amikor triptofán szint kimerült, fordítás a rövid leader peptid standokon a régió 1-es, amely lehetővé teszi, régiók, 2, 3 alkotnak egy antiterminator hurok, RNS polimeráz lehet átírni a strukturális gének a trp operon.
a prokariótákban a transzkripció és fordítás egyidejű szabályozásának egy kapcsolódó mechanizmusa egy riboswitch, egy kis régió nem kódoló RNS, amely néhány prokarióta mRNS-molekula 5 ” végén található (8.ábra). A riboswitch kötődhet egy kis intracelluláris molekulához az mRNS molekula bizonyos másodlagos struktúráinak stabilizálása érdekében., A kis molekula kötődése határozza meg, hogy mely szár-hurok szerkezet alakul ki, így befolyásolja az mRNS szintézis és a fehérjeszintézis befejezését.

8.ábra. Kattintson a nagyobb képért. A prokarióta mRNS molekulákban található Riboswitches kis intracelluláris molekulákhoz kötődhet, stabilizálva bizonyos RNS struktúrákat, befolyásolva akár az mRNS molekula szintézisének befejezését (balra), akár az mRNS (jobbra) felhasználásával készített fehérjét.,
a génexpressziót befolyásoló egyéb tényezők a prokariótákban és eukariótákban
bár a transzkripciós kontroll megvitatására összpontosítva prokarióta operonokat használtunk példaként, az eukarióta transzkripciós kontroll Sok szempontból hasonló. A prokariótákhoz hasonlóan az eukarióta transzkripció is szabályozható a transzkripciós faktorok, köztük a represszorok és aktivátorok kötődésével., Érdekes módon az eukarióta transzkripciót befolyásolhatja, hogy a fehérjék kötődnek a DNS-régiókhoz, úgynevezett enhancerekhez, meglehetősen távol a géntől, az enhancer és a promoter közötti DNS-hurkoláson keresztül (9. ábra). Összességében a transzkripció szabályozása rendkívül hatékony módja a génexpresszió szabályozásának mind a prokarióták, mind az eukarióták esetében. Az eukariótákban a génexpresszió kontrollja azonban a környezeti és sejtes stresszekre adott válaszként további módon valósítható meg anélkül, hogy transzkripciós faktorokat kötnének a szabályozó régiókhoz.,

9.ábra. Az eukariótákban az enhancer egy DNS-szekvencia, amely elősegíti a transzkripciót. Minden enhancer rövid DNS-szekvenciákból áll, amelyeket disztális vezérlő elemeknek neveznek. A disztális kontroll elemekhez kötődő aktivátorok kölcsönhatásba lépnek a mediátor fehérjékkel és a transzkripciós faktorokkal. Két különböző génnek lehet ugyanaz a promoter, de különböző disztális kontrollelemei, amelyek lehetővé teszik a differenciál gén expresszióját.,
DNS-szintű kontroll
eukariótákban a DNS-molekulák vagy a kapcsolódó hisztonok kémiailag módosíthatók oly módon, hogy befolyásolják a transzkripciót; ezt epigenetikai szabályozásnak nevezik. Metiláció bizonyos cytosine nukleotid DNS a választ, hogy a környezeti tényezők kimutatták, hogy befolyásolja az ilyen DNS transzkripció, a DNS-metiláció gyakran korreláló, hogy csökkent szintje gén kifejeződése., Továbbá, a környezeti tényezőkre reagálva, a DNS csomagolására szolgáló hiszton fehérjék kémiailag többféle módon is módosíthatók, beleértve az acetilációt és a deacetilációt, befolyásolva a DNS csomagolási állapotát, ezáltal befolyásolva a lazán sebzett DNS rendelkezésre állását a transzkripcióhoz. Ezeket a kémiai módosításokat néha a sejtosztódás több fordulóján keresztül lehet fenntartani, így legalább ezeknek az epigenetikai változásoknak egy része örökölhető.
Ez a videó leírja, hogy az epigenetikai szabályozás hogyan szabályozza a gén expresszióját.,
gondolj bele
- mi áll le, vagy lehetővé teszi a transzkripció folytatását, amikor a csillapítás működik?
- mi határozza meg a riboswitch állapotát?
- ismertesse egy enhancer funkcióját.
- írja le az epigenetikai szabályozás két mechanizmusát az eukariótákban.
klinikai fókusz: Travis, Resolution
Ez a példa arra a következtetésre jut, hogy Travis története a genetikai anyag, az RNS transzkripció funkcióiban kezdődött, és hogy az aszexuális prokarióták hogyan érik el a genetikai sokféleséget.,
bár Travis túlélte a harcot a nekrotizáló fasciitissel, most bőrátültetési műtéten kell átesnie, amelyet hosszú távú fizikai terápia követ. Az elvesztett izomtömeg mennyisége alapján nem valószínű, hogy a lába teljes erővel tér vissza, de a gyógytornász optimista, hogy visszanyeri a lábát.
laboratóriumi vizsgálatok kimutatták, hogy a Travis fertőzés kórokozója az a csoportba tartozó streptococcus (a csoport strep) törzs., Amint azt a törvény előírja, Travis ügyét jelentették az Állami Egészségügyi Minisztériumnak, végül pedig a betegség-ellenőrzési és Megelőzési központoknak (CDC). A CDC-nél a Travis-től izolált a csoport strep törzsét alaposabban elemezték a meticillin-rezisztencia szempontjából.
a meticillin-rezisztencia genetikailag kódolt, és egyre gyakoribbá válik az A csoportban a horizontális géntranszfer révén. A nekrotizáló fasciitisben a fertőzött területre történő véráramlás általában korlátozott a különböző genetikailag kódolt bakteriális toxinok hatása miatt., Ez az oka annak, hogy a metszésvizsgálat eredményeként általában kevés vagy egyáltalán nincs vérzés. Sajnos ezek a bakteriális toxinok korlátozzák az intravénás antibiotikumok hatékonyságát a fertőzés bőrből és az alapszövetből történő eltávolításában, ami azt jelenti, hogy az antibiotikum-rezisztencia önmagában nem magyarázza Travis kezelésének hatástalanságát. Mindazonáltal az intravénás antibiotikum-terápia indokolt volt a szepszis lehetséges kimenetelének minimalizálása érdekében, ami a nekrotizáló fasciitis gyakori eredménye., A Travis-től izolált törzs genomikai analízisével kimutatták, hogy számos fontos virulencia gén kódolva van a prófétákon, jelezve, hogy a transzdukció fontos ezen gének horizontális génátvitelében az egyik bakteriális sejtből a másikba.
kulcsfogalmak és összefoglaló
- a génexpresszió szigorúan szabályozott folyamat.
- A prokarióták Génexpresszióját nagyrészt a transzkripció helyén szabályozzák. Az eukariótákban a gén expresszióját emellett poszt-transzkripcionálisan szabályozzák.,
- a kapcsolódó funkciók prokarióta szerkezeti génjeit gyakran operonokba szervezik, mindegyiket egyetlen promoter transzkripciója vezérli. Az operon szabályozási régiója magában foglalja a promoter-t és a promoter-t körülvevő régiót, amelyhez a transzkripciós tényezők kötődhetnek a transzkripció befolyásolásához.
- bár egyes operonok konstitutívak, a legtöbb esetben transzkripciós faktorok (represszorok és aktivátorok) alkalmazásával szabályozhatók., Egy represszor kötődik egy operátorhoz, egy DNS-szekvencia a szabályozó régióban a promoter RNS polimeráz kötőhelye és az első szerkezeti gén között, ezáltal fizikailag blokkolja ezen operonok transzkripcióját. Egy aktivátor kötődik az operon szabályozási régiójában, segítve az RNS polimeráz kötődését a promoterhez, ezáltal növelve ennek az operonnak a transzkripcióját. Az induktor a represszorral vagy aktivátorral való kölcsönhatás révén befolyásolja a transzkripciót.
- a trp operon egy klasszikus példa egy elnyomó operonra., Amikor a triptofán felhalmozódik, a triptofán kötődik egy represszorhoz, amely ezután kötődik az operátorhoz, megakadályozva a további transzkripciót.
- a lac operon egy klasszikus példa egy indukálható operon. Ha laktóz van jelen a sejtben, akkor allolaktózsá alakul. Az allolaktóz induktorként hat, kötődik a represszorhoz, és megakadályozza, hogy a represszor kötődjön a kezelőhöz. Ez lehetővé teszi a szerkezeti gének transzkripcióját.
- a lac operon is aktiválható., Amikor a glükózszint kimerült, néhány sejtes ATP cAMP-ként alakul át, amely kötődik a katabolit aktivátor fehérjéhez (CAP). A cAMP-CAP komplex aktiválja a lac operon átírását. Ha a glükózszint magas, jelenléte megakadályozza a lac operon és más operonok katabolit elnyomással történő átírását.
- a kis intracelluláris molekulák, amelyeket alarmonoknak neveznek, különböző környezeti feszültségekre reagálnak, lehetővé téve a baktériumok számára, hogy ellenőrizzék az operonok egy csoportjának, az úgynevezett regulonnak a transzkripcióját.,
- a baktériumok képesek megváltoztatni a környezeti feltételekre adott válaszként használt RNS-polimeráz σ-faktorát, hogy gyorsan és globálisan megváltoztassák a regulonok átírását.
- A prokarióták szabályozási mechanizmusokkal rendelkeznek, beleértve a csillapítást és a riboswitches használatát, hogy egyidejűleg ellenőrizzék a transzkripció és fordítás befejezését az átiratból. Ezek a mechanizmusok a jelenleg szintetizált mRNS molekula 5 ” végén lévő szárhurok kialakulásával működnek.,
- a prokariótákban és eukariótákban a génexpresszió szabályozásának további pontjai vannak. Az eukariótákban az epigenetikai szabályozás a DNS vagy a hisztonok kémiai módosításával, az RNS-feldolgozás szabályozásával két módszer.
feleletválasztós
az enzimeket bioszintetikus úton kódoló gének operonja valószínűleg az alábbiak közül melyik?
- >
Egy operon kódoló gének átírt fordította folyamatosan biztosítani a sejt az állandó közbenső szinteken a fehérje termékek azt mondják, hogy melyik a következő?
az alábbi feltételek közül melyik vezet a lac operon maximális kifejeződéséhez?
- laktóz jelen, glükóz hiányzik
- laktóz jelen, glükóz jelen van
- laktóz hiányzik, glükóz hiányzik
- laktóz hiányzik, glükóz jelen van
az alábbiak közül melyik az eukariótákra jellemző génexpresszió szabályozásának típusa?,
- csillapítás
- alternatív σ faktor
- hisztonok kémiai módosítása
- alarmones
töltse ki az üres
a DNS-szekvenciát, amelyhez a kompresszorok kötődhetnek, amely a promoter és az első szerkezeti gén között található,_______.,
a szubsztrátot kódoló operonok expressziójának megelőzése a glükóztól eltérő szubsztrátok útvonalait a glükóz jelenlétében _______ – nek nevezzük.
gondolj rá
- milyen két módon befolyásolhatja a baktériumok egyszerre több különböző operon átírását egy adott környezeti állapotra válaszul?
- a következő szám a Monod eredeti diauxikus növekedésről szóló munkájából származik, amely az E. coli növekedését mutatja xilóz és glükóz egyidejű jelenlétében, mint az egyetlen szénforrás. Magyarázza el, hogy mi történik az a–D pontban a növekedéshez használt szénforrás tekintetében, és magyarázza el, hogy a xilóz-felhasználású operon kifejeződik-e (és miért)., Vegye figyelembe, hogy a xilóz alkalmazásához szükséges enzimek expresszióját a laktóz felhasználásához szükséges enzimek expressziójához hasonló módon szabályozzák.
